��Ŀ����
20���Ƽ��仯������й㷺����;����1�������£�Ũ�Ⱦ�Ϊ0.1mol•L-1����������������Һ��pH�����
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A��HCN B��HClO C��CH3COOH D��H2CO3
��2��ʵ�����г���NaOH������ϴ�����ᴿ��
�ٵ�300mL 1mol•L-1��NaOH��Һ���ձ�״����4.48LCO2ʱ��������Һ�и�����Ũ���ɴ�С��˳��ΪC��Na+����C��HCO3-����C��CO32-����C��OH-����C��H+����
�ڼ������ӿ�ʼ����ʱ��pH�����
| ���� | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
���� ��1��Խ����ˮ����Σ�Խ����������ӣ���ͬŨ�ȵ�������Һ��pHԽ�����ε�ˮ��̶�Խ��Ũ����ͬ����ϡ����ͬ�ı���������Խǿ������pH�仯Խ��
��2�����������ˮ��͵���غ���������ע�������ˮ�������ģ�
��ʼ����ʱpHС�������ȳ������ܶȻ�����ԽС������Խ�ȳ�����
��� �⣺��1��Խ����ˮ����Σ�Խ����������ӣ���ͬŨ�ȵ�������Һ��pHԽ�����ε�ˮ��̶�Խ����������ˮ�������̼���ƣ�����������������ӵ���������CO32-��Ũ����ͬ����ϡ����ͬ�ı���������Խǿ������pH�仯Խ��HCN��HClO��CH3COOH��H2CO3����������Դ�С˳����CH3COOH��H2CO3��HClO��HCN��������Һ��pH�仯�����Ǵ��ᣬ��ѡC��
�ʴ�Ϊ��CO32-��C��
��2��300mL 1mol•L-1��NaOH�����ʵ���=1mol/L��0.3L=0.3mol����״����4.48LCO2�����ʵ���=$\frac{4.48L}{22.4L/mol}$=0.2mol�������������ƺͶ�����̼��Ӧ����ʽΪ2CO2+3NaOH=Na2CO3+NaHCO3+H2O����Һ��̼�������ˮ���ʹ��Һ�ʼ��ԣ���C��OH-����C��H+����̼�������ˮ������̼��������ӣ�����C��HCO3-����C��CO32-��������ˮ��̶Ƚ�С������C��CO32-����C��OH-��������Һ�и�����Ũ�ȴ�С˳����C��Na+����C��HCO3-����C��CO32-����C��OH-����C��H+����
pHС�������ȳ������ܶȻ�����ԽС������Խ�ȳ���������Cu2+�ȳ�����KSP[��Fe��OH��2]��KSP[��Mg��OH��2]��
�ʴ�Ϊ��C��Na+����C��HCO3-����C��CO32-����C��OH-����C��H+����Cu2+������
���� ���⿼����������ʵĵ��롢�ε�ˮ�⡢����Ũ�ȵıȽϡ�Ksp��Ӧ�õ�֪ʶ�㣬��Ŀ�����֪ʶ��϶࣬��Ŀ�Ѷ��еȣ�ע�������Һ������Ũ�ȴ�С�Ƚϵķ�����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | �����������ѻ����͡��屽���������� | |
| B�� | �Ҵ������ᡢ��ȩ���ұ� | |
| C�� | ��������Һ�����͡��ױ������� | |
| D�� | ���ӡ�����ϩ������1��2-�������� |
| A�� | X��Y��Z | B�� | Y��X��Z | C�� | Y��Z��X | D�� | Z��Y��X |
[�������]
����һ�����������������O2��
����������������������N2��SO2��CO2�����壮
��1 ����д��H2O2����FeSO4�����ӷ���ʽ2Fe2++H2O2+2H+=2Fe3++2H2O��
[ʵ�����]
Ϊ��֤������Ƿ����������С���������ʵ������֤����ɷ֣�
�����Լ���H2O2��Һ��FeCl2��Һ��KSCN ��Һ��Ʒ����Һ�����Ը��������Һ������ʯ��ˮ��NaOH��Һ�ȣ�
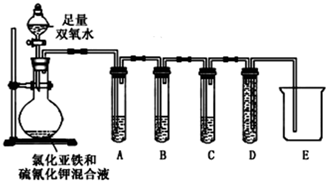
������±��е����ݣ�
| ʵ����̺����� | ���� |
| ��2���Թ�A��ʢ��Ʒ����Һ������ Ʒ����Һ��ɫ | ֤�������к���SO2 |
| ��2���Թ�B��������ɫ���Ը��������Һ��ɫ������dz ���Թ�C������������ʯ��ˮ����� | ֤�������к���CO2 |
��4 ��������Ŀ����������Ϣ��ʵ���ƶϳ����ʻ�ԭ�Ե�ǿ��˳��Fe2+��SCN-�����������������������FeCl2��KSCN���Һ�м�������˫��ˮ����Һ�ȱ�죬˵��˫��ˮ��������Fe2+��
��5 ����ͬѧ��Ϊ��KSCN �������IJ����п��ܻ�����SO42-�������һ����ʵ����֤��
| ʵ����� | ʵ�������� |
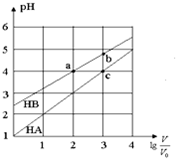 �����£�Ũ�Ⱦ�Ϊ0.10mol/L�������ΪV0��HA��HB��Һ���ֱ��ˮϡ�������V��pH��$lg\frac{V}{V_0}$�ı仯��ͼ��ʾ������������ȷ���ǣ�������
�����£�Ũ�Ⱦ�Ϊ0.10mol/L�������ΪV0��HA��HB��Һ���ֱ��ˮϡ�������V��pH��$lg\frac{V}{V_0}$�ı仯��ͼ��ʾ������������ȷ���ǣ�������| A�� | ���¶���HB�ĵ���ƽ�ⳣ��Լ����1.11��10-5 | |
| B�� | ��ͬ������NaA��Һ��pH����NaB��Һ��pH | |
| C�� | ��Һ��ˮ�ĵ���̶ȣ�a=c��b | |
| D�� | ��$lg\frac{V}{V_0}=3$ʱ��������Һͬʱ�����¶ȣ���$\frac{{c��{B^-}��}}{{c��{A^-}��}}$��С |
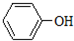 �����б����ϵ�һ���ⱻ-C3H7ԭ����ȡ���γɵ��л��ﹲ�У�������
�����б����ϵ�һ���ⱻ-C3H7ԭ����ȡ���γɵ��л��ﹲ�У�������| A�� | 15�� | B�� | 12�� | C�� | 9�� | D�� | 6�� |
��֪�������������������pH
| Mn��OH��2 | Fe��OH��2 | Fe��OH��3 | Cu��OH��2 | |
| ��ʼ����ʱ | 8.3 | 6.3 | 2.7 | 4.7 |
| ��ȫ����ʱ | 9.8 | 8.3 | 3.7 | 6.7 |
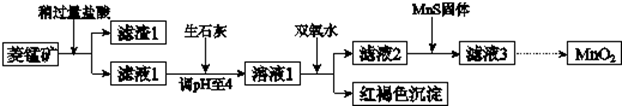
�ش��������⣺
��1�������ʵ����̿�ʹ��ǰ�轫����飬��ҪĿ��������Ӵ��������߷�Ӧ���ʣ������ܽ�MnCO3�Ļ�ѧ����ʽ��MnCO3+2HCl=MnCl2+CO2��+H2O��
��2������Һ1�м���˫��ˮʱ����Ӧ�����ӷ���ʽ��2Fe2++H2O2+4H2O=2Fe��OH��3��+4H+��
��3����Һ2�м����Թ��������ܵ����MnS���Գ�ȥCu2+����Ӧ�����ӷ���ʽ��MnS+Cu2+=Mn2++CuS��
��4����MnCl2ת��ΪMnO2��һ�ַ���������������������������ữ��NaClO3��Һ��MnCl2�������÷�Ӧ�����ӷ���ʽΪ��5Mn2++2ClO3-+4H2O=Cl2��+5MnO2+8H+��
��5����MnCl2ת��ΪMnO2����һ�ַ����ǵ�ⷨ��
������MnO2�ĵ缫��Ӧʽ��Mn2+-2e-+2H2O=MnO2+4H+��
����������MnCl2��Һ�м���һ������Mn��NO3��2��ĩ������Cl2��������ԭ�����������������£�����Mn2+Ũ��[������c��Mn2+��/c��Cl-��]��������Mn2+�ŵ磨������Cl-�ŵ磩��
