题目内容
20.如图是周期表中短周期的一部分,若a原子最外层的电子数比次外层少了3个,则下列说法不正确的是( )
| A. | d的氢化物比b的氢化物稳定 | |
| B. | d与c不能形成化合物 | |
| C. | a、b、c的最高价氧化物对应水化物的酸性强弱的关系是c>b>a | |
| D. | 原子半径的大小顺序是a>b>c>d |
分析 由元素在短周期中的位置可知d位于第二周期,a、b、c位于第三周期,a原子最外层电子数比次外层电子数少3个,故a原子最外层电子数为5,故a为P元素,可知b为S元素,c为Cl元素,d为O元素,结合元素周期律解答.
解答 解:由元素在短周期中的位置可知d位于第二周期,a、b、c位于第三周期,a原子最外层电子数比次外层电子数少3个,故a原子最外层电子数为5,故a为P元素,可知b为S元素,c为Cl元素,d为O元素.
A.非金属性O>S,非金属性越强氢化物越稳定,故d的氢化物比b的氢化物稳定,故A正确;
B.氧元素与氯元素可以形成多种氯的氧化物,故B错误;
C.同周期自左而右非金属性增强,故非金属性a<b<c,非金属性越强最高价氧化物对应水化物的酸性越强,故最高价氧化物对应水化物的酸性c>b>a,故C正确;
D.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径P>S>Cl>O,即a>b>c>d,故D正确;
故选B.
点评 本题考查结构位置性质关系应用,题目难度中等,推断元素为解答关键,注意整体把握元素周期表的结构,熟练掌握元素周期律.

练习册系列答案
相关题目
10.把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是( )
| A. | 溶液中Ca2+数目减少 | B. | 溶液pH值增大 | ||
| C. | 溶液中c(Ca2+)增大 | D. | 溶液pH值不变 |
8.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4•7H2O),设计了如图流程:下列说法不正确的是( )
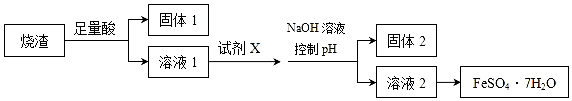

| A. | 溶液1中的阳离子可与NH4+、HCO3-、I-、SO42-在同一溶液中大量共存 | |
| B. | 向溶液2中加入3-5滴K3[Fe(CN)6](铁氰化钾)溶液,可观察到有蓝色沉淀生成 | |
| C. | 向固体2中加入足量NaOH溶液,发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O | |
| D. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 |
15.工业上在一定条件下将丙烷脱氢制丙烯.
(1)反应过程中能量变化如图1所示,下列有关叙述正确的是ac.
a.此反应为吸热反应
b.催化剂能改变反应的焓变和活化能
c.E1表示正反应的活化能,E2表示逆反应的活化能
d.有催化剂能加快反应速率,提高丙烷的转化率
(2)上述反应在恒温恒容密闭容器中达到平衡,其平衡常数K的表达式为K=$\frac{c(C{H}_{2}=C{H}_{2})c({H}_{2})}{c(C{H}_{3}C{H}_{2}C{H}_{3})}$.若升温,该反应的平衡常数增大(填“增大”、“减小”或“不变”).若向上述反应达到平衡的容器内再通入少量丙烷,则$\frac{c(C{H}_{2}=CHC{H}_{3})}{c(C{H}_{3}C{H}_{2}C{H}_{3})}$减小(填“增大”、“减小”或“不变”).
(3)在0.1MPa、800K条件下,向恒容密闭容器中通入丙烷和稀有气体,丙烷脱氢反应的转化率随着稀有气体与丙烷比例的变化情况如图2所示,则随着稀有气体与丙烷比例的增加,丙烷转化率逐渐增大的原因是此反应是气体体积和增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压,从而促进反应向正反应方向进行,提高了丙烷脱氢的转化率.

(4)上述反应生成物丙烯经多步氧化生成丙酸,已知常温下Ka(CH3CH2COOH)=1.3×10-5.Kb(NH3•H2O)=1.8×10-5.
①用离子方程式表示CH3CH2COONa溶液显碱性的原因CH3CH2COO-+H2O?CH3COOH+OH-.
②常温下,若丙酸与氨水混合后溶液呈中性,则溶液中$\frac{c(C{H}_{3}C{H}_{2}CO{O}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=1.3×109.
(5)已知:
则丙烷脱氢反应的热化学方程式为CH3CH2CH3(g)?CH2=CHCH3(g)+H2(g)△H=+126kJ/mol.
(1)反应过程中能量变化如图1所示,下列有关叙述正确的是ac.
a.此反应为吸热反应
b.催化剂能改变反应的焓变和活化能
c.E1表示正反应的活化能,E2表示逆反应的活化能
d.有催化剂能加快反应速率,提高丙烷的转化率
(2)上述反应在恒温恒容密闭容器中达到平衡,其平衡常数K的表达式为K=$\frac{c(C{H}_{2}=C{H}_{2})c({H}_{2})}{c(C{H}_{3}C{H}_{2}C{H}_{3})}$.若升温,该反应的平衡常数增大(填“增大”、“减小”或“不变”).若向上述反应达到平衡的容器内再通入少量丙烷,则$\frac{c(C{H}_{2}=CHC{H}_{3})}{c(C{H}_{3}C{H}_{2}C{H}_{3})}$减小(填“增大”、“减小”或“不变”).
(3)在0.1MPa、800K条件下,向恒容密闭容器中通入丙烷和稀有气体,丙烷脱氢反应的转化率随着稀有气体与丙烷比例的变化情况如图2所示,则随着稀有气体与丙烷比例的增加,丙烷转化率逐渐增大的原因是此反应是气体体积和增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压,从而促进反应向正反应方向进行,提高了丙烷脱氢的转化率.

(4)上述反应生成物丙烯经多步氧化生成丙酸,已知常温下Ka(CH3CH2COOH)=1.3×10-5.Kb(NH3•H2O)=1.8×10-5.
①用离子方程式表示CH3CH2COONa溶液显碱性的原因CH3CH2COO-+H2O?CH3COOH+OH-.
②常温下,若丙酸与氨水混合后溶液呈中性,则溶液中$\frac{c(C{H}_{3}C{H}_{2}CO{O}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=1.3×109.
(5)已知:
| 化学键 | H-H | C-H | C-C | C=C |
| 键能(kJ•mol-1) | 436 | 413 | 348 | 612 |
5.新制氯水中存在平衡:Cl2+H2O?HCl+HClO若向氯水中投入少量CaCO3粉末,则( )
| A. | 平衡不移动 | |
| B. | 平衡向正反应方向移动,Cl2的转化率增大 | |
| C. | 平衡移动,且HClO浓度减小 | |
| D. | 平衡移动,且HClO浓度增大 |
12.硫可以形成分子式为S2、S4、S6、S8的单质,其中S8的分子结构如图所示.下列有关说法正确的是( )
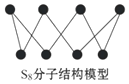

| A. | S2、S4、S6、S8互为同位素 | |
| B. | S2的摩尔质量为32 g/mol | |
| C. | 硫的单质在足量的空气中完全燃烧可生成SO3 | |
| D. | 1 mol S8单质中含有的S-S键个数为8NA |
9.下列盐溶液呈中性的是( )
| A. | NaHCO3 | B. | NH4C1 | C. | KNO3 | D. | CH3COONa |


 、
、 .
. +2 NaOH$→_{△}^{水}$
+2 NaOH$→_{△}^{水}$ +NaOH+H2O.
+NaOH+H2O. +2 Ag(NH3)2OH$\stackrel{△}{→}$
+2 Ag(NH3)2OH$\stackrel{△}{→}$ +2 Ag↓+3NH3+H2O.
+2 Ag↓+3NH3+H2O.
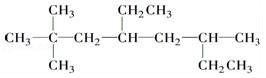 的名称为2,2,6-三甲基-4-乙基辛烷.
的名称为2,2,6-三甲基-4-乙基辛烷.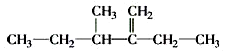 的名称为3-甲基-2-乙基-1-戊烯.
的名称为3-甲基-2-乙基-1-戊烯.