题目内容
1.除去某溶液里溶解的少量杂质(括号内的物质为杂质),下列做法中不正确的是( )| A. | .NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,再加适量盐酸并加热 | |
| B. | .KNO3溶液(AgNO3):加过量KCl溶液,过滤 | |
| C. | .NaCl溶液(Br2):加CCl4,分液 | |
| D. | .FeSO4溶液(CuSO4):加过量铁粉、过滤 |
分析 A.加过量Na2CO3溶液会和杂质氯化钡反应生成碳酸钡沉淀和氯化钠,碳酸钠与适量盐酸并加热可以将碳酸根除去;
B.加过量KCl溶液会和硝酸银反应生成氯化银沉淀和硝酸钾,过滤,滤液是硝酸钾和过量氯化钾的混合物;
C.溴单质容易溶解在四氯化碳中;
D.Fe与CuSO4溶液发生反应:CuSO4+Fe=FeSO4+Cu.
解答 解:A.加过量Na2CO3溶液会和杂质氯化钡反应生成碳酸钡沉淀和氯化钠,过滤,滤液是氯化钠和过量的碳酸钠,然后再加适量盐酸并加热可以将碳酸根除去,故B正确;
B.加过量KCl溶液会和硝酸银反应生成氯化银沉淀和硝酸钾,过滤,滤液是硝酸钾和过量氯化钾的混合物,又引进了新杂质,故C错误;
C.溴单质容易溶解在四氯化碳中,分液获得氯化钠溶液和溶有碘的四氯化碳互不相溶的两部分,故C正确;
D.Fe与CuSO4溶液发生反应:CuSO4+Fe=FeSO4+Cu,然后过滤,得到的溶液就是FeSO4溶液,故D正确.
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12. 利用下图装置测定中和热的实验步骤如下:
利用下图装置测定中和热的实验步骤如下:
①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)倒入NaOH溶液的正确操作是C(从下列选出).
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是D(从下列选出).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-56.8kJ/mol(取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 利用下图装置测定中和热的实验步骤如下:
利用下图装置测定中和热的实验步骤如下:①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)倒入NaOH溶液的正确操作是C(从下列选出).
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是D(从下列选出).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4℃ |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
10.1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g)+a Y(g)?b Z(g).反应达到平衡后,测得X的转化率为25%.而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的$\frac{5}{6}$,则a和b的数值可能是( )
| A. | a=1,b=2 | B. | a=2,b=1 | C. | a=2,b=2 | D. | a=3,b=2 |
11.化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是( )
| A. | 次氯酸具有强氧化性,可以起到除去水中悬浮的杂质和杀菌消毒作用 | |
| B. | 为防止中秋月饼等富脂食品氧化变质,常在包装中放入生石灰 | |
| C. | 金属汞一旦洒落在地面或桌面时,必须尽可能收集,并深埋处理 | |
| D. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
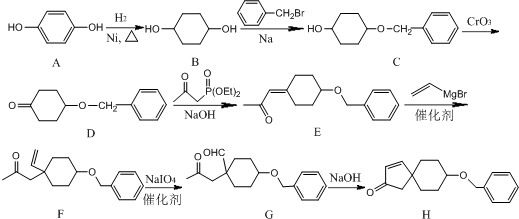
 ;由C→D的反应类型是氧化反应.
;由C→D的反应类型是氧化反应.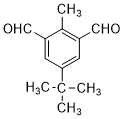 或
或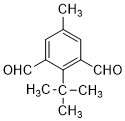 .
. 为有机原料制备
为有机原料制备 的合成路线流程图(无机试剂任选,可选择适当有机溶剂).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选,可选择适当有机溶剂).合成路线流程图示例如下: