题目内容
19.完成下列方程式或离子方程式(1)丙烯聚合为聚丙烯

(2)二氧化碳通入苯酚钠溶液C6H5ONa+CO2+H2O→C6H5OH+NaHCO3或C6H5O-+CO2+H2O→C6H5OH+HCO3-
(3)乙二醇与氧气在铜作催化剂下加热CH2OH-CH2OH+O2$→_{△}^{催化剂}$CHO-CHO+2H2O
(4)碳酸钠溶液水解(离子)CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-.
分析 (1)丙烯分子中含有碳碳双键,在一定条件下能够发生加聚反应生成聚丙烯,据此写出该反应的化学方程式;
(2)苯酚钠溶液通入二氧化碳反应生成苯酚和碳酸氢钠;
(3)乙醇在铜的催化氧化下生成乙醛和水,乙二醇中含有两个可被氧化的端基醇,据此解答;
(4)碳酸根离子为二元弱酸酸根离子,分步水解生成碳酸和氢氧根离子.
解答 解:(1)聚丙烯分子中含有不饱和的碳碳双键,在一定条件下能够发生加聚反应得到聚丙烯,反应的化学方程式为: ,
,
故答案为: ;
;
(2)二氧化碳通入苯酚钠溶液反应生成苯酚和碳酸氢钠,反应的化学方程式为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,离子反应为C6H5O-+CO2+H2O→C6H5OH+HCO3-,
故答案为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3或C6H5O-+CO2+H2O→C6H5OH+HCO3-;
(3)乙二醇一定条件下催化氧化得到乙二醛,化学反应方程式为:CH2OH-CH2OH+O2$→_{△}^{催化剂}$CHO-CHO+2H2O,
故答案为:CH2OH-CH2OH+O2$→_{△}^{催化剂}$CHO-CHO+2H2O;
(4)碳酸根离子为二元弱酸酸根离子,分步水解:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,
故答案为:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-.
点评 本题考查反应方程式书写,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,侧重有机物性质及反应的考查,题目难度不大.

练习册系列答案
相关题目
10.1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g)+a Y(g)?b Z(g).反应达到平衡后,测得X的转化率为25%.而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的$\frac{5}{6}$,则a和b的数值可能是( )
| A. | a=1,b=2 | B. | a=2,b=1 | C. | a=2,b=2 | D. | a=3,b=2 |
14.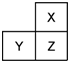 X、Y、Z是三种短周期的主族元素,在周期表中的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X、Y、Z是三种短周期的主族元素,在周期表中的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
 X、Y、Z是三种短周期的主族元素,在周期表中的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X、Y、Z是三种短周期的主族元素,在周期表中的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )| A. | 气态氢化物的热稳定性:X>Z | |
| B. | 原子半径:X<Y<Z | |
| C. | Y和Z的最高价氧化物对应水化物均为强酸 | |
| D. | 若Z的最高正价为+m,则X的最高正价也一定为+m |
4.含6.02×1023个中子的${\;}_3^7Li$的质量是( )
| A. | $\frac{7}{4}g$ | B. | 4.7 g | C. | 7.4 g | D. | $\frac{4}{7}g$ |
11.化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是( )
| A. | 次氯酸具有强氧化性,可以起到除去水中悬浮的杂质和杀菌消毒作用 | |
| B. | 为防止中秋月饼等富脂食品氧化变质,常在包装中放入生石灰 | |
| C. | 金属汞一旦洒落在地面或桌面时,必须尽可能收集,并深埋处理 | |
| D. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
8.下列各组物质中,所含原子数相等的是( )
| A. | 10g H2和10g O2 | B. | 标准状况下相同体积的N2和H2 | ||
| C. | 9g水和0.25mol H2 | D. | 22g CO2和3.01×1023个N2 |