题目内容
在下列条件下,能大量共存的微粒组是( )


| A、c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- |
| B、上表提供的数据下:HClO、HCO3-、ClO-、CO32- |
| C、能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- |
| D、中性的溶液中:CO32-、Na+、SO42-、AlO2- |
考点:离子共存问题
专题:
分析:A.c(H+)=1×10-14mol/L的溶液,显碱性;
B.由表中的数据可知,酸性HClO>HCO3-;
C.与Al反应生成H2的溶液,为非氧化性酸或强碱溶液;
D.中性溶液中不能存在水解显碱性的离子.
B.由表中的数据可知,酸性HClO>HCO3-;
C.与Al反应生成H2的溶液,为非氧化性酸或强碱溶液;
D.中性溶液中不能存在水解显碱性的离子.
解答:
解:A.c(H+)=1×10-14mol/L的溶液,显碱性,该组离子之间不反应,可大量共存,故A正确;
B.由表中的数据可知,酸性HClO>HCO3-所以HClO和CO32-二者发生强酸制取弱酸的反应,不能共存,故B错误;
C.与Al反应生成H2的溶液,为非氧化性酸或强碱溶液,碱溶液中不能存在NH4+,酸溶液中NO3-、I-(或Al)发生氧化还原反应,不能共存,故C错误;
D.CO32-、AlO2-均水解显碱性,与中性溶液不符,故D错误;
故选A.
B.由表中的数据可知,酸性HClO>HCO3-所以HClO和CO32-二者发生强酸制取弱酸的反应,不能共存,故B错误;
C.与Al反应生成H2的溶液,为非氧化性酸或强碱溶液,碱溶液中不能存在NH4+,酸溶液中NO3-、I-(或Al)发生氧化还原反应,不能共存,故C错误;
D.CO32-、AlO2-均水解显碱性,与中性溶液不符,故D错误;
故选A.
点评:本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,选项BD为解答的关键,注意选项B中表格数据的应用,题目难度不大.

练习册系列答案
相关题目
有关如图及实验的描述不正确的是( )
A、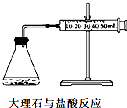 可以测量大理石与盐酸的反应速率 |
B、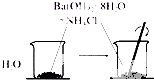 说明吸热反应也可能是自发反应 |
C、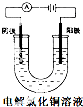 两个电极都为铜片时,电解初期溶液的浓度基本不改变 |
D、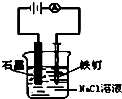 实验中,铁钉上会有刺激性气体产生 |
化学与生活密切相关,下列有关说法不正确的是( )
| A、陶瓷是人类应用很早的硅酸盐材料 |
| B、对海洋资源开发可获得Fe、Co、K、Au、Mg、B、I等金属 |
| C、氮的固定不定都要在高温、高压、催化剂的条件下才能实现 |
| D、控制工业废水和生活污水的排放可以有效地防止水体污染,改善水质 |
下列叙述错误的是( )
| A、铝热反应中可得到铁,但工业上不用该反应来大量生产铁 |
| B、可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
| C、明矾和漂白粉常用于自来水的净化和杀菌消毒,两者原理相同 |
| D、生成盐和水的反应不一定是中和反应 |
在给定条件的水溶液中可能大量共存的离子组是( )
| A、c(H+):c(OH-)=1:2的溶液:K+、Al3+、HCO3-、ClO- |
| B、与Al反应生成H2的溶液:Na+、Ba2+、NO3-、Cl- |
| C、中性溶液中:SO32-、S2-、Fe3+、Cl- |
| D、能使红色酚酞变无色的溶液:K+、Ca2+、Cl-、HCO3- |
 某温度下,将2mol A和3mol B充入一密闭容器中,发生反应aA(g)+B(g)?C(g)+D(g),5min后达到平衡.已知该温度下其平衡常数K=1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )
某温度下,将2mol A和3mol B充入一密闭容器中,发生反应aA(g)+B(g)?C(g)+D(g),5min后达到平衡.已知该温度下其平衡常数K=1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )| A、a=2 |
| B、达平衡时A的转化率为60% |
| C、速率随时间变化关系如右图所示 |
| D、为提高A的转化率,可采取升高温度的措施 |
下列说法中正确的是( )
| A、铁在潮湿空气中生锈是自发过程 |
| B、电解池的反应是属于自发反应 |
| C、NH4NO3溶于水吸热,说明其溶于水不是自发过程 |
| D、非自发反应在任何条件下一定都不能发生 |
下列离子方程式正确的是( )
| A、石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| B、硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
| C、氧化铜与稀硫酸反应:2H++O2-═H2O |
| D、碳酸氢钠溶液中加入盐酸:CO32-+2H+═CO2↑+H2O |