题目内容
有关如图及实验的描述不正确的是( )
A、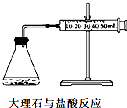 可以测量大理石与盐酸的反应速率 |
B、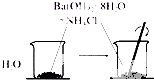 说明吸热反应也可能是自发反应 |
C、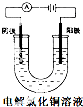 两个电极都为铜片时,电解初期溶液的浓度基本不改变 |
D、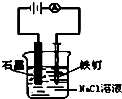 实验中,铁钉上会有刺激性气体产生 |
考点:化学实验方案的评价
专题:
分析:A.根据单位时间内注射器的读数判断;
B.Ba(OH)2?8H2O与NH4Cl反应是吸热反应;
C.阳极铜单质失电子变成铜离子;
D.阳极铁失电子.
B.Ba(OH)2?8H2O与NH4Cl反应是吸热反应;
C.阳极铜单质失电子变成铜离子;
D.阳极铁失电子.
解答:
解:A.根据单位时间内注射器的读数判断反应速率,故A正确;
B.Ba(OH)2?8H2O与NH4Cl反应是吸热反应,烧杯底部的水会结冰,说明能自发进行,故B正确;
C.阳极铜单质失电子变成铜离子,阴极铜离子得电子形成铜单质,故C正确;
D.阳极铁失电子,阴极氢离子得电子,故D错误.
故选D.
B.Ba(OH)2?8H2O与NH4Cl反应是吸热反应,烧杯底部的水会结冰,说明能自发进行,故B正确;
C.阳极铜单质失电子变成铜离子,阴极铜离子得电子形成铜单质,故C正确;
D.阳极铁失电子,阴极氢离子得电子,故D错误.
故选D.
点评:本题考查较为综合,涉及化学反应速率的测定、自发反应、电解池以及金属的腐蚀等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大.

练习册系列答案
相关题目
在做中和热实验测定中和热时,应使用的仪器正确的组合是:( )
①量筒 ②托盘天平 ③烧杯 ④容量瓶 ⑤冷凝管 ⑥温度计 ⑦酒精灯.
①量筒 ②托盘天平 ③烧杯 ④容量瓶 ⑤冷凝管 ⑥温度计 ⑦酒精灯.
| A、①③⑥ | B、②③⑤ |
| C、①②③⑥ | D、全部 |
在工业生产中,降低能耗是重要的节能措施.下列说法不符合生产实际的是( )
| A、使用恰当的还原剂,可以在较低的温度下把金属从矿石中提取出来 |
| B、研制出性能优良的催化剂可以使反应温度降低,提高反应速率,从而起到节能效果 |
| C、制水泥、玻璃等硅酸盐工业需要消耗大量能源,我们应通过降低其产量来节能 |
| D、利用铝的还原性和铝转化为氧化铝时能放出大量热的性质,工业上常用铝粉来还原一些金属氧化物 |
下列说法不正确的是( )
| A、氟氯烃的肆意排放会加速臭氧层的破坏,使大气层中的紫外线增强 |
| B、除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤后分液、干燥、蒸馏即可 |
| C、淀粉、蛋白质、油脂均是天然高分子化合物 |
| D、不慎将苯酚沾到皮肤上应立即用酒精清洗 |
下列说法中正确的是(NA表示阿伏伽德罗常数)( )
| A、28g N2所含有的原子数为NA |
| B、1.8g的NH4+离子中含有电子数11NA |
| C、22.4LCH4的质量与NA个甲烷分子的质量之和相等 |
| D、标准状况下,22.4LCH4和O2的混合气体所含有的分子数为NA |
下列反应中属于加成反应的是( )
A、CH4+Cl2
| |||
| B、CH2=CH2+Br2→CH2BrCH2Br | |||
C、2CH3CH2OH+O2
| |||
D、 |
在下列条件下,能大量共存的微粒组是( )


| A、c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- |
| B、上表提供的数据下:HClO、HCO3-、ClO-、CO32- |
| C、能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- |
| D、中性的溶液中:CO32-、Na+、SO42-、AlO2- |
 如右图,假定五环中的一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应,且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )
如右图,假定五环中的一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应,且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )