题目内容
6.能够证明甲烷分子的空间结构为正四面体的事实是( )| A. | 甲烷的二氯代物只有1种 | B. | 甲烷分子中4个C-H键的长度相同 | ||
| C. | 甲烷的一氯代物只有1种 | D. | 甲烷分子中4个C-H键的强度相同 |
分析 A.如果甲烷是正方形的平面结构,而CH2Cl2有两种结构:相邻或者对角线上的氢被Cl取代,而实际上,其二氯取代物只有一种结构,因此只有正四面体结构才符合;
B.甲烷如果是平面结构,甲烷的4个碳氢键的键长也相等;
C.甲烷若是平面结构,甲烷中的四个氢原子位置也相同;
D.若是平面正方形结构,甲烷的4个碳氢键的键长、键能也相等,4个C-H键的强度相同.
解答 解:A.若为平面正方形结构,二氯甲烷有两种同分异构体,而正四面体的二氯甲烷不存在同分异构体,故A正确;
B.甲烷无论是正四面体结构,还是正方形,甲烷的4个碳氢键的键长都相等,无法判断甲烷的结构,故B错误;
C.甲烷无论是正四面体结构,还是正方形,其一氯代物只有1种,不能说明分子结构,故C错误;
D.由于甲烷为平面正方形结构时,甲烷的4个碳氢键的键能也相等,即4个C-H键的强度相同,所以无法判断甲烷是否为正四面体结构,故D错误;
故选A.
点评 本题考查甲烷的分子结构,题目难度不大,注意掌握常见有机物的结构与性质,明确二氯甲烷没有同分异构体说明甲烷是正四面体结构.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
16.下列实验操作中有错误的是( )
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 实验室制取蒸馏水的装置中,温度计水银球应位于蒸馏烧瓶的支管口处 | |
| C. | 用萃取的方法分离碘水 | |
| D. | 用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液蒸干 |
17.某微粒的结构示意图为 ,当x-y=10时,该微粒为( )
,当x-y=10时,该微粒为( )
 ,当x-y=10时,该微粒为( )
,当x-y=10时,该微粒为( )| A. | 原子 | B. | 阳离子 | C. | 阴离子 | D. | 无法判断 |
14.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1L 1mol•L-1的NaClO溶液含有ClO-的数目为NA | |
| B. | 22.4 L Cl2分别与足量的Cu、Fe完全反应转移电子数分别为2NA、3NA | |
| C. | 常温常压下,14g由N2和CO组成的混合气体含有的电子总数为7NA | |
| D. | 14.2g硫酸钠固体含有0.l NA个硫酸钠分子 |
15.同温度下的两种稀氨水A和B,A的浓度为c mol•L-1、电离度为α1;B溶液中c(NH4+)为c mol•L-1、电离度为α2.则下列判断错误的是( )
| A. | A溶液中的c(OH-)是B溶液中的c(OH-)的α1倍 | |
| B. | α1>α2 | |
| C. | B溶液的物质的量浓度可表示为$\frac{c}{{α}_{2}}$mol•L-1 | |
| D. | pH:溶液A>溶液B |
16.关于化学键的叙述中,正确的是( )
| A. | HCl电离产生H+和 Cl-,可判断HCl分子中存在离子键 | |
| B. | NaHSO4固体中含有的阴离子与阳离子的个数比为1:1 | |
| C. | 化学键是指使原子或离子相互结合的静电吸引作用力 | |
| D. | 不同元素组成的多原子分子中的化学键一定全是极性键 |
 如图所示装置中,M棒变细,N棒变粗.由此判断下表中所列M、N、R物质,其中合理的是( )
如图所示装置中,M棒变细,N棒变粗.由此判断下表中所列M、N、R物质,其中合理的是( )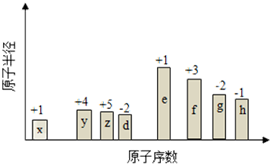 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或 最低负价的变化如图所示. 根据判断出的元素回答问题:
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或 最低负价的变化如图所示. 根据判断出的元素回答问题: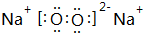 ,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.
,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.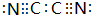 ,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是(CN)2+2NaOH=NaCN+NaCNO+H2O.
,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是(CN)2+2NaOH=NaCN+NaCNO+H2O.