题目内容
15.同温度下的两种稀氨水A和B,A的浓度为c mol•L-1、电离度为α1;B溶液中c(NH4+)为c mol•L-1、电离度为α2.则下列判断错误的是( )| A. | A溶液中的c(OH-)是B溶液中的c(OH-)的α1倍 | |
| B. | α1>α2 | |
| C. | B溶液的物质的量浓度可表示为$\frac{c}{{α}_{2}}$mol•L-1 | |
| D. | pH:溶液A>溶液B |
分析 氨水中的一水合氨是弱碱,在溶液中部分电离,已知A溶液的浓度是c mol/L,B溶液中c(NH4+)为c mol/L,所以B溶液的浓度大于c mol/L,浓度越大电离程度越小,据此分析.
解答 解:A.A溶液的浓度是c mol/L,c(NH4+)=c×α1c mol/L,B溶液中c(NH4+)为c mol/L,则A溶液中的c(NH4+)是B溶液中的c(NH4+)的α1倍,所以A溶液中的c(OH-)是B溶液中的c(OH-)的α1倍,故A正确;
B.A溶液的浓度是c mol/L,B溶液的浓度大于c mol/L,浓度越大电离程度越小,所以A溶液氨水的电离程度大于B溶液氨水的电离程度,即α1>α2,故B正确;
C.B溶液中c(NH4+)=c(氨水)α2=cmol/L,所以溶液的物质的量浓度可表示为$\frac{c}{{α}_{2}}$mol•L-1,故C正确;
D.A溶液的c(OH-)小于B溶液的c(OH-),所以A溶液的pH小于B溶液的pH,故D错误.
故选D.
点评 本题考查了弱电解质的电离,题目难度中等,注意弱电解质溶液的浓度越大电解质的电离程度越小,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
相关题目
5.电子数相等的微粒叫等电子体,下列各组微粒属于等电子体的是( )
| A. | N2O4和NO2 | B. | CH4 和NH4+ | C. | Al3+ 和 HCl | D. | NO 和CO |
6.能够证明甲烷分子的空间结构为正四面体的事实是( )
| A. | 甲烷的二氯代物只有1种 | B. | 甲烷分子中4个C-H键的长度相同 | ||
| C. | 甲烷的一氯代物只有1种 | D. | 甲烷分子中4个C-H键的强度相同 |
10.X、Y、Z、W、R 的原子序数依次增大,X 单质在暗处与H 2剧烈化合并发生爆炸,Y 原子的最外层只有1个电子,Z 所处的周期序数与族序数相等,W 元素最高正价与最低负价绝对值相等,R 与 X同族,则( )
| A. | 原子半径:Y>Z>X | |
| B. | X与R的核电荷数相差18 | |
| C. | 气态氢化物稳定性:W>R | |
| D. | Y与Z两者最高价氧化物对应的水化物能相互反应 |
20.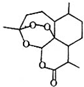 屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命.青蒿素分子结构如图.下列说法错误的是( )
屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命.青蒿素分子结构如图.下列说法错误的是( )
 屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命.青蒿素分子结构如图.下列说法错误的是( )
屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命.青蒿素分子结构如图.下列说法错误的是( )| A. | 青蒿素的分子式为C15H22O5 | B. | 青蒿素是芳香族化合物 | ||
| C. | 青蒿素可以发生水解反应 | D. | 青蒿素不能使酸性KMnO4溶液褪色 |
4.工业焊接钢管常用55137Cs进行“无损探伤”.下列有关说法正确的是( )
| A. | 137表示质量数 | B. | 137表示质子数 | ||
| C. | 该原子质子数大于中子数 | D. | 55表示中子数 |
5.某有机物在标准状况下其密度为1.25g•L-1,则这种有机物的分子式可能是( )
| A. | CO | B. | C2H6 | C. | CH4 | D. | C2H4 |