题目内容
20.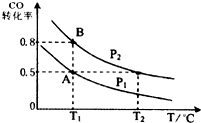 甲醇可作为燃料电池的原料.通过下列反应可以制备甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1在一容积可变的密闭容器中充入10mol CO 和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A时,容器的体积为20L.
甲醇可作为燃料电池的原料.通过下列反应可以制备甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1在一容积可变的密闭容器中充入10mol CO 和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A时,容器的体积为20L.(1)T1℃反应的平衡常数为4.
(2)图中P1< P2(填“>”、“<”或“=”).
(3)如反应开始时仍充入10mol CO和20mol H2,则在平衡状态B 时容器的体积V(B)=4L.
(4)关于反应CO(g)+2H2(g)?CH3OH(g)在化学平衡状态时的描述正确的是AD(填字母,下同).
A.CO 的含量保持不变
B.容器中CH3OH 浓度与H2 浓度相等
C.2v正(CH3OH)=v 正(H2)
D.容器中混合气体的平均相对分子质量保持不变
(5)已知CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ•mol-1,试写出由CO2和H2制取气态甲醇和气态水的热化学方程式CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5kJ•mol-1.
分析 (1)结合图象T1、P1状态下CO的转化率为0.5,根据三段式列式计算反应平衡时个物质的量,计算K;
(2)正反应方向为气体体积减小的方向,T1℃时比较CO的转化率,转化率越大,则压强越大;
(3)A、B反应温度相等,则平衡常数相等,根据三段式列出B状态下各组分浓度,利用平衡常数计算;
(4)根据化学平衡状态的特征:正逆反应速率相同,各成分浓度保持不变分析判断选项;
(5)已知:①CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1
②CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ•mol-1
根据盖斯定律,①+②可得.
解答 解:(1)分析图象可知,A状态下CO的转化率为0.5,则CO转化了10mol×0.5=5mol,根据三段式:
CO(g)+2H2(g)?CH3OH
起始物质的量:10 20 0
转化物质的量:5 10 5
平衡物质的量:5 10 5
当达到平衡状态A时,容器的体积为20L.则平衡常数K=$\frac{5mol÷20L}{(5mol÷20L)•(10mol÷20L)^2}$=4;
故答案为:4;
(2)正反应方向为气体体积减小的方向,T1℃时比较CO的转化率,转化率越大,则压强越大,图象中P2转化率大于P1,可知P1<P2;
故答案为:<;
(3)分析图象得B点时CO的转化率为0.8,根据三段式:
CO(g)+2H2(g)?CH3OH(g)
起始(mol):10 20 0
转化(mol):8 16 8
平衡(mol):2 4 8
设体积为VL,A、B两容器温度相同,即化学平衡常数相等,则有K=$\frac{(8÷V)}{(2÷V)•(4÷V)^2}$=4,解得V=4L;
故答案为:4;
(4)A.CO的含量保持不变,说明反应达到平衡,故A正确;
B.容器中CH3OH浓度与CO浓度相等,与消耗量和起始量有关反应不一定达到平衡,故B错误;
C.反应速率之比等于化学方程式系数之比是正反应速率之比,2V正(CH3OH)=V正(H2),均是指正反应速率,不能判断达到化学平衡状态,故C错误;
D.混合气体质量不变,反应前后体积不同,反应过程中密度变化,容器中混合气体的密度保持不变说明反应达到平衡,故D正确;
故答案为:AD;
(5)已知:①CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1
②CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ•mol-1
根据盖斯定律,①+②可得:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5 kJ•mol-1;
故答案为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5 kJ•mol-1
点评 本题考查盖斯定律,图象分析以及三段式计算的应用等,考查范围广,难度中等,对于化学平衡状态的判断和电极反应式是高考的热点,能够熟练应用.

| A. | 标准状况下,22.4L水中所含的分子数约为6.02×1023 | |
| B. | 标准状况下,aL的氧气和氮气的混合物含有的分子数约为a/22.4×6.02×1023 | |
| C. | 常温常压下,48g O3气体含有的氧原子数为6.02×1023 | |
| D. | 2.24L CO2中含有的原子数为0.3×6.02×1023 |
| A. | 金属原子化热:Na<Mg<Al | B. | 晶格能:NaBr<NaCl<MgO | ||
| C. | 键的极性:N-H<O-H<F-H | D. | 熔点: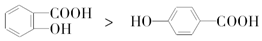 |
| A. | 增加溶液pH | B. | 加入2.0 mol/L NH4Cl | ||
| C. | 加入0.1 mol/L MgSO4 | D. | 加入适量95%乙醇 |
| A. | 易溶于水 | B. | 此AgCl更难溶于水 | ||
| C. | 与AgCl一样难溶于水 | D. | 无法确定溶解性 |
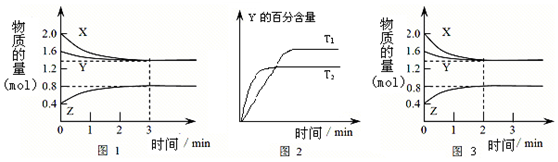
| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 0~3min内,v(X)=0.1 mol/(L•min) | |
| C. | 达平衡后,升高温度,v正、v逆都增大,且再次平衡前v正<v逆 | |
| D. | 若改变条件,使反应进程如图3所示,则改变的条件可能是增大压强 |
 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: