题目内容
5.欲增加Mg(OH)2在水中的溶解,可采用的方法是( )| A. | 增加溶液pH | B. | 加入2.0 mol/L NH4Cl | ||
| C. | 加入0.1 mol/L MgSO4 | D. | 加入适量95%乙醇 |
分析 平衡Mg(OH)2(s)?Mg2+(aq)+2OH-(aq)正向移动,可增加Mg(OH)2在水中的溶解,以此来解答.
解答 解:A.增加溶液pH,碱性增强,平衡逆向移动,减弱在水中的溶解,故A不选;
B.加入2.0 mol/L NH4Cl,与OH-反应,OH-浓度减小,平衡正向移动,增加Mg(OH)2在水中的溶解,故B选;
C.加入0.1 mol/L MgSO4,Mg2+浓度增大,平衡逆向移动,减弱在水中的溶解,故C不选;
D.加入适量95%乙醇,对Mg(OH)2在水中的溶解基本无影响,故D不选;
故选B.
点评 本题考查沉淀溶解平衡,为高频考点,把握离子浓度与平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意平衡移动原理的应用,题目难度不大.

练习册系列答案
相关题目
10.随着我国经济的飞速发展,居民家用小汽车拥有量大幅攀升,汽车尾气带来的空气污染不容忽视.汽车尾气中,两种污染物能在催化剂作用下转化为无害物质,这两种污染物是( )
| A. | CO2和NO | B. | CO和NO | C. | CO2和O2 | D. | 碳氢化合物和O3 |
11.用NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 1molOH-所含质子数为10NA | |
| B. | 常温常压下,28克CO和N2的混合气体所含原子数为2NA | |
| C. | 4g氢气中含有的原子数为2NA | |
| D. | 标准状况下,11.2L酒精含有的分子数为0.5NA |
13.金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3 (s)+3H2(g)$\stackrel{高温}{?}$ W (s)+3H2O(g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{c^3({H}_{2}O)}{c^3({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示:
第一阶段反应的化学方程式为2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为1:1:4.
(4)已知:温度过高时,WO2 (s)转变为WO2(g);
WO2 (s)+2H2 (g)?W (s)+2H2O (g);△H=+66.0kJ•mol-1
WO2 (g)+2H2?W (s)+2H2O (g);△H=-137.9kJ•mol-1
则WO2(s)?WO2 (g) 的△H=+203.9kJ•mol-1.
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{c^3({H}_{2}O)}{c^3({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
(4)已知:温度过高时,WO2 (s)转变为WO2(g);
WO2 (s)+2H2 (g)?W (s)+2H2O (g);△H=+66.0kJ•mol-1
WO2 (g)+2H2?W (s)+2H2O (g);△H=-137.9kJ•mol-1
则WO2(s)?WO2 (g) 的△H=+203.9kJ•mol-1.
10.石灰乳中存在下列平衡:Ca(OH)2(s)?Ca2+(aq)+2OH- (aq),加入下列溶液,可使Ca(OH)2减少的是( )
| A. | Na2S溶液 | B. | AlCl3溶液 | C. | NaOH溶液 | D. | CaCl2溶液 |
17.硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是( )


| A. | 温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小 | |
| B. | 三个不同温度中,313K时Ksp(SrSO4)最小 | |
| C. | 283K时,图中a点对应的溶液是不饱和溶液 | |
| D. | 283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液 |
14. 某兴趣小组设计如下微型实验装置.实验时,先断开 K2,闭合 K1,两极均有气泡产生; 一段时间后,断开 K1,闭合 K2,发现电流表指针偏转,下列有关描述正确的是( )
某兴趣小组设计如下微型实验装置.实验时,先断开 K2,闭合 K1,两极均有气泡产生; 一段时间后,断开 K1,闭合 K2,发现电流表指针偏转,下列有关描述正确的是( )
 某兴趣小组设计如下微型实验装置.实验时,先断开 K2,闭合 K1,两极均有气泡产生; 一段时间后,断开 K1,闭合 K2,发现电流表指针偏转,下列有关描述正确的是( )
某兴趣小组设计如下微型实验装置.实验时,先断开 K2,闭合 K1,两极均有气泡产生; 一段时间后,断开 K1,闭合 K2,发现电流表指针偏转,下列有关描述正确的是( )| A. | 断开 K2,闭合 K1时,总反应的离子方程式为:2H++2Cl-$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑ | |
| B. | 断开 K2,闭合 K1时,石墨电极附近溶液变红 | |
| C. | 断开 K1,闭合 K2时,铜电极上的电极反应为:Cl2+2e-=2Cl- | |
| D. | 断开 K1,闭合 K2 时,石墨电极作正极 |
15.NA为阿伏加德罗常数,下列说法中一定正确的是( )
| A. | 标准状况下,22.4LH2O所含有原子数为3NA | |
| B. | 1mol OH-中含电子数目为9NA | |
| C. | 标准状况下,11.2LN2和NO的混合气体所含的原子数为NA | |
| D. | 每燃烧12gC,转移的电子数目为4NA |
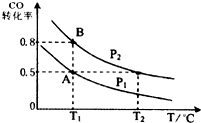 甲醇可作为燃料电池的原料.通过下列反应可以制备甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1在一容积可变的密闭容器中充入10mol CO 和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A时,容器的体积为20L.
甲醇可作为燃料电池的原料.通过下列反应可以制备甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1在一容积可变的密闭容器中充入10mol CO 和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A时,容器的体积为20L.