题目内容
8. 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)═Si3N4(s)+6CO(g)
(1)该反应的平衡常数表达式为K=$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$;
(2)若知上述反应为放热反应,则其反应热△H<0(填“>”、“<”或“=”);升高温度,其平衡常数值减小(填“增大”、“减小”或“不变”);
若已知CO生成速率为v(CO)=18mol•L-1•min-1,则N2消耗速率为v(N2)=6mol•L-1•min-1
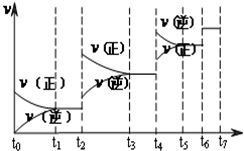
(3)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图.图中t4时引起平衡移动的条件可能是增大压强或升高温度;
(4)图中表示平衡混合物中CO的含量最高的一段时间是t3~t4.
(5)已知:2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ•mol-1;H2O(g)=H2O(l)△H=-44kJ•mol-1,;由此可知H2燃烧热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-285.8•mol-1;.
分析 (1)根据化学平衡常数的概:平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,注意固体度为常数,不写入;
(2)对于放热反应,反应热△H<0;对于放热反应,温度升高,平衡逆向移动,K减小;根据速率之比等于化学计量数之比计算;
(3)若不改变H2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为压缩体积增大压强,由(2)已知反应为放热反应,升高温度速率加快,反应逆向移动也可;
(4)t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂,t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高;
(5)已知:①2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ•mol-1;
②H2O(g)=H2O(l)△H=-44kJ•mol-1,根据盖斯定律,结合燃烧热的概念可得答案.
解答 解:(1)可逆反应3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)的平衡常数K=$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$;
故答案为:K=$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$
(2)对于放热反应,反应热△H<0;对于放热反应,温度升高,平衡逆向移动,K减小;已知CO生成速率为v(CO)=18mol•L-1•min-1,根据速率之比等于化学计量数之比,则N2消耗速率为v(N2)=$\frac{1}{3}$×18mol•L-1•min-1=6mol•L-1•min-1;
故答案为:<;减小; 6mol•L-1•min-1
(3)若不改变H2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为压缩体积增大压强,由(2)已知反应为放热反应,升高温度速率加快,反应逆向移动也可;
故答案为:增大压强或升高温度
(4)t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂,t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高;
故答案为:t3~t4
(5)已知:①2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ•mol-1;
②H2O(g)=H2O(l)△H=-44kJ•mol-1,
根据燃烧热的热化学方程式的概念:1mol可燃物充分燃烧生成稳定氧化物的热化学方程式,由盖斯定律:
$①×\frac{1}{2}$+②可得:H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-285.8•mol-1;
故答案为:H2(g)+$\frac{1}{2}$ O2(g)═H2O(l);△H=-285.8 kJ•mol-1
点评 考查化学平衡常数与影响因素、影响平衡移动的因素、化学反应速率计算、盖斯定律等,比较基础,注意方程式中物质的状态和燃烧热的概念,注意基础知识的掌握.

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案①单位时间内生成n molO2的同时生成2n mol NO2
②单位时间内生成n molO2的同时生成2n mol NO
③混合气体的颜色不再改变的状态
④用NO2、NO、O2表示的反应速率的比为2:2:1的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
⑧2V正(NO2)=2V逆(O2)
| A. | ①③⑥⑦ | B. | ②⑤⑥⑦ | C. | ①③④⑤⑧ | D. | ①②③④⑤⑥⑦⑧ |
| A. | 1molOH-所含质子数为10NA | |
| B. | 常温常压下,28克CO和N2的混合气体所含原子数为2NA | |
| C. | 4g氢气中含有的原子数为2NA | |
| D. | 标准状况下,11.2L酒精含有的分子数为0.5NA |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{c^3({H}_{2}O)}{c^3({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
(4)已知:温度过高时,WO2 (s)转变为WO2(g);
WO2 (s)+2H2 (g)?W (s)+2H2O (g);△H=+66.0kJ•mol-1
WO2 (g)+2H2?W (s)+2H2O (g);△H=-137.9kJ•mol-1
则WO2(s)?WO2 (g) 的△H=+203.9kJ•mol-1.

| A. | 温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小 | |
| B. | 三个不同温度中,313K时Ksp(SrSO4)最小 | |
| C. | 283K时,图中a点对应的溶液是不饱和溶液 | |
| D. | 283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液 |
| A. | 灼烧的铁丝在氯气中燃烧,集气瓶内充满棕黄色烟雾 | |
| B. | 氢气在氯气中燃烧,集气瓶口有白雾 | |
| C. | 向盛水的烧杯中先加入过氧化钠,再滴加酚酞,最终溶液呈红色 | |
| D. | 将Cl2通入紫色石蕊溶液中,溶液变红色 |
 甲醇可作为燃料电池的原料.通过下列反应可以制备甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1在一容积可变的密闭容器中充入10mol CO 和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A时,容器的体积为20L.
甲醇可作为燃料电池的原料.通过下列反应可以制备甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1在一容积可变的密闭容器中充入10mol CO 和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A时,容器的体积为20L.