题目内容
制备氮化硅可将硅粉放在氮气中高温直接氮化制得,实验室制备氮化硅装置如图所示: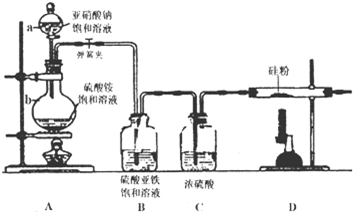
(1)写出仪器的名称:a ,b .
(2)写出NaNO2和(NH4)2SO4反应制备氮气的离子方程式 .
(3)(NH4)2SO4水溶液呈 性(填:酸、碱或中),装置C的作用是 .
(4)装置A和D中,应首先加热的是 (填:A或D).
(5)已知氮化硅的化学性质稳定,但常温下易溶于氢氟酸溶液生成一种白色的胶状沉淀和一种盐,请写出此化学反应方程式: .

(1)写出仪器的名称:a
(2)写出NaNO2和(NH4)2SO4反应制备氮气的离子方程式
(3)(NH4)2SO4水溶液呈
(4)装置A和D中,应首先加热的是
(5)已知氮化硅的化学性质稳定,但常温下易溶于氢氟酸溶液生成一种白色的胶状沉淀和一种盐,请写出此化学反应方程式:
考点:制备实验方案的设计
专题:
分析:(1)根据实验装置图分析;
(2)在加热条件下NaNO2和(NH4)2SO4反应生成氮气、硫酸钠和水;
(3)铵根离子在溶液中水解显酸性;浓硫酸具有吸水性,可作干燥剂;
(4)先制备氮气,把装置中的空气排净,然后再制备氮化硅;
(5)氮化硅溶于氢氟酸溶液生成一种白色的胶状沉淀为硅酸,根据元素守恒确定另一种产物.
(2)在加热条件下NaNO2和(NH4)2SO4反应生成氮气、硫酸钠和水;
(3)铵根离子在溶液中水解显酸性;浓硫酸具有吸水性,可作干燥剂;
(4)先制备氮气,把装置中的空气排净,然后再制备氮化硅;
(5)氮化硅溶于氢氟酸溶液生成一种白色的胶状沉淀为硅酸,根据元素守恒确定另一种产物.
解答:
解:(1)根据实验装置图a为加液装置为分液漏斗,b为反应装置为圆底烧瓶;
故答案为:分液漏斗;圆底烧瓶;
(2)在加热条件下NaNO2和(NH4)2SO4反应生成氮气、硫酸钠和水,其反应的离子方程式为:NO2-+NH4+
N2↑+2H2O;
故答案为:NO2-+NH4+
N2↑+2H2O;
(3)铵根离子在溶液中水解显酸性,则(NH4)2SO4水溶液呈酸性;浓硫酸具有吸水性,可作干燥剂,所以装置C的作用是干燥气体除去水蒸气;
故答案为:酸;除去水蒸气;
(4)在加热条件下,Si与氧气能反应生成二氧化硅,所以要先排净装置中的空气,所以先加热A制备氮气,把装置中的空气排净,然后再加热B制备氮化硅;
故答案为:A;
(5)氮化硅溶于氢氟酸溶液生成一种白色的胶状沉淀为硅酸,元素守恒确定另一种产物为NH4F,则反应的方程式为:Si3N4+4HF+9H2O=3H2SiO3↓+4NH4F;
故答案为:Si3N4+4HF+9H2O=3H2SiO3↓+4NH4F.
故答案为:分液漏斗;圆底烧瓶;
(2)在加热条件下NaNO2和(NH4)2SO4反应生成氮气、硫酸钠和水,其反应的离子方程式为:NO2-+NH4+
| ||
故答案为:NO2-+NH4+
| ||
(3)铵根离子在溶液中水解显酸性,则(NH4)2SO4水溶液呈酸性;浓硫酸具有吸水性,可作干燥剂,所以装置C的作用是干燥气体除去水蒸气;
故答案为:酸;除去水蒸气;
(4)在加热条件下,Si与氧气能反应生成二氧化硅,所以要先排净装置中的空气,所以先加热A制备氮气,把装置中的空气排净,然后再加热B制备氮化硅;
故答案为:A;
(5)氮化硅溶于氢氟酸溶液生成一种白色的胶状沉淀为硅酸,元素守恒确定另一种产物为NH4F,则反应的方程式为:Si3N4+4HF+9H2O=3H2SiO3↓+4NH4F;
故答案为:Si3N4+4HF+9H2O=3H2SiO3↓+4NH4F.
点评:本题考查了制备方案设计,题目难度中等,侧重于考查学生的实验探究能力,注意把握硅及其化合物的性质,明确实验目的和实验原理是解题的关键.

练习册系列答案
相关题目
将10mL 5mol/L的HCl溶液稀释到200mL,从中取出5mL,这5mL溶液的物质的量浓度为( )
| A、0.5mo/L |
| B、0.25mol/L |
| C、0.1mol/L |
| D、1mol/L |
下列反应的离子方程式中正确的是( )
| A、硫酸亚铁溶液中加入用硫酸酸化过的过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O |
| B、过量的二氧化硫通入漂白粉溶液中:ClO-+SO2+H2O=HClO+HSO3 |
| C、向氯化铝溶液中加入过量的氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| D、碳酸氢铵溶液中加入过量的氢氧化钠溶液:HCO3-+OH-=CO32-+H2O |
下列各项比较中前者高于(或大于或强于)后者的是( )
| A、CCl4和SiCl4的熔点 |
| B、I2在水中的溶解度和I2在CCl4溶液中的溶解度 |
C、对羟基苯甲醛(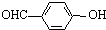 )和邻羟基苯甲醛( )和邻羟基苯甲醛(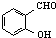 )的沸点 )的沸点 |
| D、H2SO3和H2SO4的酸性 |
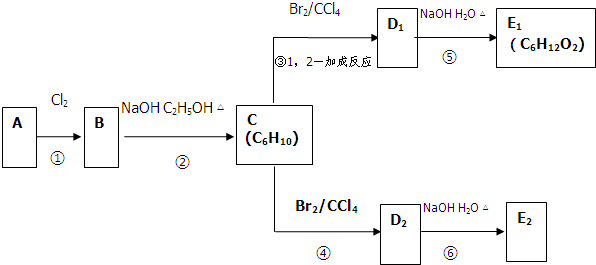
 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
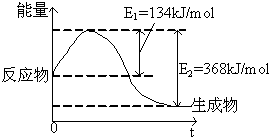 如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.
如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.