题目内容
某实验小组拟用50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入的CO2气体过量生成NaHCO3,设计了如下实验步骤:
①用25mL NaOH溶液吸收CO2气体,至CO2气体不再溶解;
②小火煮沸溶液1min~2min;
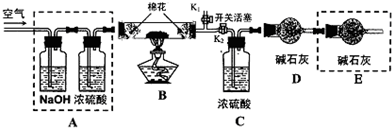
③在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合.此方案能制得较纯净的Na2CO3(第一步的实验装置如图甲所示)

(1)写出①、③两步的化学反应的离子方程式① .③
(2)装置B中盛放的试剂是 ,作用是 .
(3)实验室中吸收尾气的方法很多.如图乙装置中可以用来吸收氨气的是 .
①用25mL NaOH溶液吸收CO2气体,至CO2气体不再溶解;
②小火煮沸溶液1min~2min;
③在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合.此方案能制得较纯净的Na2CO3(第一步的实验装置如图甲所示)

(1)写出①、③两步的化学反应的离子方程式①
(2)装置B中盛放的试剂是
(3)实验室中吸收尾气的方法很多.如图乙装置中可以用来吸收氨气的是
考点:性质实验方案的设计,制备实验方案的设计
专题:实验设计题
分析:A中大理石和盐酸反应生成二氧化碳,通过饱和碳酸氢钠溶液,可除去二氧化碳气体中的HCl,
①用25mL NaOH溶液吸收CO2气体,至CO2气体不再溶解,二者完全反应生成NaHCO3,发生NaOH+CO2=NaHCO3;
②小火煮沸溶液1min~2min,可除去溶液中过量的CO2;
③在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合,发生NaHCO3+NaOH=Na2CO3+H2O,得较纯净的Na2CO3,
如用图2吸收氨气,因氨气易溶于水,注意防止倒吸.
①用25mL NaOH溶液吸收CO2气体,至CO2气体不再溶解,二者完全反应生成NaHCO3,发生NaOH+CO2=NaHCO3;
②小火煮沸溶液1min~2min,可除去溶液中过量的CO2;
③在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合,发生NaHCO3+NaOH=Na2CO3+H2O,得较纯净的Na2CO3,
如用图2吸收氨气,因氨气易溶于水,注意防止倒吸.
解答:
解:(1)用25mL NaOH溶液吸收CO2气体,至CO2气体不再溶解,二者完全反应生成NaHCO3,反应的离子方程式为OH-+CO2=HCO3-,
在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合,发生NaHCO3+NaOH=Na2CO3+H2O,离子方程式为HCO3-+OH-═CO32-+H2O,
故答案为:OH-+CO2=HCO3-;HCO3-+OH-═CO32-+H2O;
(2)盐酸易挥发,制取的二氧化碳含有HCl,B中盛放饱和碳酸氢钠溶液,吸收HCl气体,同时生成二氧化碳,
故答案为:饱和碳酸氢钠溶液;除去HCl气体;
(3)A.吸收装置中的导管下连漏斗,漏斗的边缘紧靠液面,有缓冲作用气体充分被吸收能防止倒吸,故A正确;
B.吸收装置中的导气管插入到液面,易吸收易溶性气体,但产生倒吸,故B错误;
C.与A相似,可起到防止倒吸作用,故C正确;
D.尾气没有被吸收,而是排放到大气中造成污染,故D错误;
E.吸收装置中的导管没直接伸入到液体中,而是与烧瓶连接紧密,有缓冲作用气体充分被吸收,能防止倒吸,故E正确.
故选ACE.
在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合,发生NaHCO3+NaOH=Na2CO3+H2O,离子方程式为HCO3-+OH-═CO32-+H2O,
故答案为:OH-+CO2=HCO3-;HCO3-+OH-═CO32-+H2O;
(2)盐酸易挥发,制取的二氧化碳含有HCl,B中盛放饱和碳酸氢钠溶液,吸收HCl气体,同时生成二氧化碳,
故答案为:饱和碳酸氢钠溶液;除去HCl气体;
(3)A.吸收装置中的导管下连漏斗,漏斗的边缘紧靠液面,有缓冲作用气体充分被吸收能防止倒吸,故A正确;
B.吸收装置中的导气管插入到液面,易吸收易溶性气体,但产生倒吸,故B错误;
C.与A相似,可起到防止倒吸作用,故C正确;
D.尾气没有被吸收,而是排放到大气中造成污染,故D错误;
E.吸收装置中的导管没直接伸入到液体中,而是与烧瓶连接紧密,有缓冲作用气体充分被吸收,能防止倒吸,故E正确.
故选ACE.
点评:本题考查学生对于实验方案的理解、实验装置的理解、气密性检验、试剂的选择、化学计算等,为高频考点,侧重于学生的分析能力和实验能力的考查,难度中等,(3)注意防止倒吸的装置.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
对于某些离子的检验及结论一定正确的是( )
| A、取样,加入紫色石蕊,溶液变红,一定有H+ |
| B、取样,加入氯化钡溶液有白色沉淀产生.再加盐酸,沉淀不消失,一定有SO42- |
| C、取样,加入硝酸银有白色沉淀,一定有Cl- |
| D、取样,加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
在恒温恒容条件下,能使A(g)+2B(s)?C(g)+3D(g)的正反应速率增大的措施是( )
| A、减小C的浓度 |
| B、增大B的量 |
| C、减小D的浓度 |
| D、增大A的量 |