题目内容
碱式碳酸镁和无水氯化镁具有广泛的用途.
●用白云石(CaCO3?MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如下:
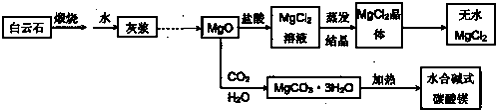
回答下列问题:
(1)“灰浆”中除水和MgO外,主要成分还有:
(2)从MgCl2晶体得到无水MgCl2的操作为:
●为探究所制得的水合碱式碳酸镁(m MgCO3?n Mg(OH)2?x H2O)的组成.某同学组装仪器如图所示:
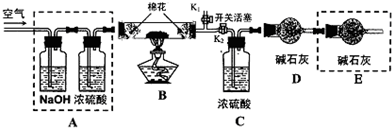
(3)实验测得:硬质玻璃管中剩余的固体质量为1.60g,C处浓H2SO4增重0.72g,D处碱石灰增重1.32g,此水合碱式碳酸镁的化学式为:
(4)A框中装置的作用是 ;在装好试剂后,加热前应进行的操作是 .
(5)若将E框中的装置去掉,对实验结果的影响是 .
●用白云石(CaCO3?MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如下:

回答下列问题:
(1)“灰浆”中除水和MgO外,主要成分还有:
(2)从MgCl2晶体得到无水MgCl2的操作为:
●为探究所制得的水合碱式碳酸镁(m MgCO3?n Mg(OH)2?x H2O)的组成.某同学组装仪器如图所示:

(3)实验测得:硬质玻璃管中剩余的固体质量为1.60g,C处浓H2SO4增重0.72g,D处碱石灰增重1.32g,此水合碱式碳酸镁的化学式为:
(4)A框中装置的作用是
(5)若将E框中的装置去掉,对实验结果的影响是
考点:物质分离和提纯的方法和基本操作综合应用,探究物质的组成或测量物质的含量
专题:实验设计题
分析:(1)碳酸钙、碳酸镁分解得到氧化钙、氧化镁,都可以和水反应得到氢氧化物;
(2)镁离子在水溶液中会发生水解反应得到氢氧化镁,所以应抑制镁离子在水溶液中的水解;
(3)碱式碳酸镁可以看成是碳酸镁和氢氧化镁的混合物,根据二氧化碳确定碳酸镁的量,根据水确定氢氧化镁的量,据此确定化学式即可;
(4)要排除空气中的水以及二氧化碳的干扰,开始之前要先通空气,排尽装置中的空气;
(5)根据最后的碱石灰的作用:吸收空气中水蒸气和CO2等来回答.
(2)镁离子在水溶液中会发生水解反应得到氢氧化镁,所以应抑制镁离子在水溶液中的水解;
(3)碱式碳酸镁可以看成是碳酸镁和氢氧化镁的混合物,根据二氧化碳确定碳酸镁的量,根据水确定氢氧化镁的量,据此确定化学式即可;
(4)要排除空气中的水以及二氧化碳的干扰,开始之前要先通空气,排尽装置中的空气;
(5)根据最后的碱石灰的作用:吸收空气中水蒸气和CO2等来回答.
解答:
(1)碳酸钙、碳酸镁分解得到氧化钙、氧化镁,都可以和水反应得到氢氧化物:Ca(OH)2和Mg(OH)2故答案为:Ca(OH)2和Mg(OH)2;
(2)镁离子在水溶液中会发生水解反应得到氢氧化镁,所以应抑制镁离子在水溶液中的水解,故从MgCl2晶体得到无水MgCl2的操作在HCl气流中进行,
故答案为:将MgCl2?6H2O晶体在干燥的HCl气流中加热;
(3)设水合碱式碳酸镁的化学式为mMgCO3?nMg(OH)2,
mMgCO3?nMg(OH)2?xH2O
(m+n)MgO+mCO2↑+(n+x)H2O
80(m+n) 44m 18(n+x)
1.60 1.32 0.72
则:
=
=
,解得x=3,n=1,m=3,即3MgCO3?Mg(OH)2?3H2O,
故答案为:3MgCO3?Mg(OH)2?3H2O;
(4)实验需要通过测量D装置内碱石灰的增重,计算生成的二氧化碳的质量,通过测量C装置装置,计算生成的水的质量,所以A是吸收空气中的水蒸气和二氧化碳;
要排除空气中的水以及二氧化碳的干扰,开始之前要先通空气,排尽装置中的空气,再进行试验,
故答案为:除去空气中的水蒸气和CO2等酸性气体;关闭K2,打开K1,通入足量空气后,再打开K2,关闭K1;
(5)实验需要通过测量D装置内碱石灰的增重,计算生成的二氧化碳的质量,通过测量C装置装置,计算生成的水的质量故A是吸收空气中的水蒸气和二氧化碳,防止进入D装置中,如果没有E装置,D中碱石灰会吸收空气中水蒸气和CO2等酸性气体,产生误差,测得m偏大,n偏小,最后的碱石灰的作用:吸收空气中水蒸气和CO2等,不能去掉,
故答案为:D中碱石灰会吸收空气中水蒸气和CO2等酸性气体,产生误差,测得m偏大,n偏小;
(2)镁离子在水溶液中会发生水解反应得到氢氧化镁,所以应抑制镁离子在水溶液中的水解,故从MgCl2晶体得到无水MgCl2的操作在HCl气流中进行,
故答案为:将MgCl2?6H2O晶体在干燥的HCl气流中加热;
(3)设水合碱式碳酸镁的化学式为mMgCO3?nMg(OH)2,
mMgCO3?nMg(OH)2?xH2O
| ||
80(m+n) 44m 18(n+x)
1.60 1.32 0.72
则:
| 80(m+n) |
| 1.60 |
| 44m |
| 1.32 |
| 18(n+x) |
| 0.72 |
故答案为:3MgCO3?Mg(OH)2?3H2O;
(4)实验需要通过测量D装置内碱石灰的增重,计算生成的二氧化碳的质量,通过测量C装置装置,计算生成的水的质量,所以A是吸收空气中的水蒸气和二氧化碳;
要排除空气中的水以及二氧化碳的干扰,开始之前要先通空气,排尽装置中的空气,再进行试验,
故答案为:除去空气中的水蒸气和CO2等酸性气体;关闭K2,打开K1,通入足量空气后,再打开K2,关闭K1;
(5)实验需要通过测量D装置内碱石灰的增重,计算生成的二氧化碳的质量,通过测量C装置装置,计算生成的水的质量故A是吸收空气中的水蒸气和二氧化碳,防止进入D装置中,如果没有E装置,D中碱石灰会吸收空气中水蒸气和CO2等酸性气体,产生误差,测得m偏大,n偏小,最后的碱石灰的作用:吸收空气中水蒸气和CO2等,不能去掉,
故答案为:D中碱石灰会吸收空气中水蒸气和CO2等酸性气体,产生误差,测得m偏大,n偏小;
点评:本题考查学生物质的组成和含量的测定,注重实验能力的考查,注意实验原理的探究是关键,难度大.

练习册系列答案
相关题目
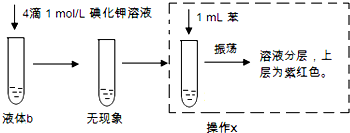 据报道双氧水接触银能剧烈反应,为消除用硝酸清洗试管内壁上的银时产生的有毒气体污染环境,体现“绿色化学”的理念,某学校活动小组利用该反应清洗试管内壁上的银,并进一步研究反应的机理.他们查阅资料(资料信息:硝酸氧化性比过氧化氢强,能氧化过氧化氢;碘化银为黄色固体;稀硝酸与银单质反应条件为加热),设计并完成了以下实验.
据报道双氧水接触银能剧烈反应,为消除用硝酸清洗试管内壁上的银时产生的有毒气体污染环境,体现“绿色化学”的理念,某学校活动小组利用该反应清洗试管内壁上的银,并进一步研究反应的机理.他们查阅资料(资料信息:硝酸氧化性比过氧化氢强,能氧化过氧化氢;碘化银为黄色固体;稀硝酸与银单质反应条件为加热),设计并完成了以下实验.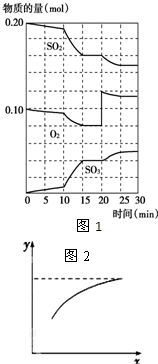 硫酸生产中,接触室内的反应为:
硫酸生产中,接触室内的反应为:
