题目内容
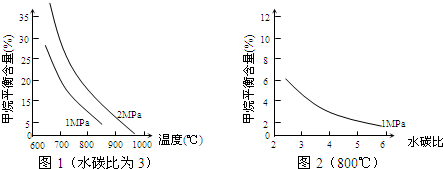
工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).
已知温度、压强和水碳比[
])]对甲烷平衡含量(%)的影响如图1:
(1)CH4(g)+H2O(g)?CO(g)+3H2(g).的△H 0 (填“>”或“<”);若在恒温、恒压时,向该平
衡体系中通入氦气平衡将 移动(填“向正应方向”、“向逆反应方向”或“不”).
(2)温度对该反应的反应速率和平衡移动的影响是 .
(3)其他条件不变,请在图2中画出压强为2MPa时,甲烷平衡含量(%)与水碳比之间关系曲线.(只要求画出大致的变化曲线)
(4)已知:在700℃,1MPa时,1mol CH4与1mol H2O在2L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字.)
已知温度、压强和水碳比[
| n(H2O) |
| n(CH4) |
(1)CH4(g)+H2O(g)?CO(g)+3H2(g).的△H
衡体系中通入氦气平衡将
(2)温度对该反应的反应速率和平衡移动的影响是
(3)其他条件不变,请在图2中画出压强为2MPa时,甲烷平衡含量(%)与水碳比之间关系曲线.(只要求画出大致的变化曲线)
(4)已知:在700℃,1MPa时,1mol CH4与1mol H2O在2L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字.)

考点:化学平衡的计算
专题:
分析:(1)从图1看出温度升高,甲烷的含量降低,根据勒夏特列原理,升高温度,平衡向吸热方向移动,故正反应为吸热反应;
(2)根据图象中可以看出升高温度,反应速率加快,甲烷的百分含量减小,平衡向正反应方向移动;
(3)根据压强不变时,甲烷的百分含量随水碳比增大而减小来画出曲线;
(4)利用三段式计算平衡时各组分的平衡浓度,再根据v=
计算v(H2),代入平衡常数表达式K=
计算其平衡常数.
(2)根据图象中可以看出升高温度,反应速率加快,甲烷的百分含量减小,平衡向正反应方向移动;
(3)根据压强不变时,甲烷的百分含量随水碳比增大而减小来画出曲线;
(4)利用三段式计算平衡时各组分的平衡浓度,再根据v=
| △c |
| △t |
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
解答:
解:(1)从图1看出温度升高,甲烷的含量降低,正反应为吸热反应,反应热△H>0;
若在恒温恒压时,向该平衡体系中通入氦气,使容器体积变大,平衡向气体体积增大的方向移动,即向正反应方向移动;
故答案为:>;向正反应方向;
(2)由图象可知,其他条件不变,升高温度,反应速率加快,甲烷的百分含量减小,平衡向正反应方向移动,
故答案为:其他条件不变,升高温度,反应速率加快,平衡向正反应方向移动;
(3)其他条件不变,压强为2MPa时,CH4平衡含量随水碳比的增大而减小,其关系曲线为 ;
;
故答案为: ;
;
(4)根据化学平衡三段式计算 CH4(g)+H2O(g)?CO(g)+3H2(g)
起始浓度(mol/L):0.5 0.5 0 0
变化浓度(mol/L):0.4 0.4 0.4 1.2
平衡浓度(mol/L):0.1 0.1 0.4 1.2
v(H2)=
=
=0.2mol?L-1?min-1;
平衡常数K=
=
=69.1.
答:6分钟H2的平均反应速率和该温度下反应的平衡常数分别为0.2mol?L-1?min-1、69.1.
若在恒温恒压时,向该平衡体系中通入氦气,使容器体积变大,平衡向气体体积增大的方向移动,即向正反应方向移动;
故答案为:>;向正反应方向;
(2)由图象可知,其他条件不变,升高温度,反应速率加快,甲烷的百分含量减小,平衡向正反应方向移动,
故答案为:其他条件不变,升高温度,反应速率加快,平衡向正反应方向移动;
(3)其他条件不变,压强为2MPa时,CH4平衡含量随水碳比的增大而减小,其关系曲线为
 ;
;故答案为:
 ;
;(4)根据化学平衡三段式计算 CH4(g)+H2O(g)?CO(g)+3H2(g)
起始浓度(mol/L):0.5 0.5 0 0
变化浓度(mol/L):0.4 0.4 0.4 1.2
平衡浓度(mol/L):0.1 0.1 0.4 1.2
v(H2)=
| △c(H2) |
| △t |
| 1.2mol/L |
| 6min |
平衡常数K=
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
| 0.4×1.23 |
| 0.1×0.1 |
答:6分钟H2的平均反应速率和该温度下反应的平衡常数分别为0.2mol?L-1?min-1、69.1.
点评:本题比较综合,涉及反应热计算、化学平衡图象及影响因素、反应速率与平衡常数计算等,是对基础知识的应用,注意掌握盖斯定律计算反应热,难度中等.

练习册系列答案
相关题目

 用如图装置测定某铁的氧化物中铁元素和氧元素的质量比,记录如下:
用如图装置测定某铁的氧化物中铁元素和氧元素的质量比,记录如下:
