题目内容
17.对于反应CO(g)+H2O(g)?H2(g)+CO2(g)△H<0,在其他条件不变的情况下,下列说法正确的是( )| A. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| B. | 改变压强(压缩气体或扩大容积),平衡不发生移动,反应放出的热量不变 | |
| C. | 升高温度,反应速率加快,反应放出的热量不变 | |
| D. | 若在原电池中进行,反应放出的热量不变 |
分析 A.催化剂虽然改变了反应途径,但是△H只取决于反应物、生成物的状态;
B.反应前后气体的化学计量数之和相等,增大压强,平衡不移动;
C.升高温度,平衡逆向移动;
D.若在原电池中进行,反应将化学能转换为电能.
解答 解:A.催化剂虽然改变了反应途径,反应物、生成物的状态不变,所以其△H不变,故A错误;
B.反应前后气体的化学计量数之和相等,增大压强,平衡不移动,则反应放出的热量不变,故B正确;
C.升高温度,平衡逆向移动,则反应放出的热量减少,故C错误;
D.若在原电池中进行,反应不放出热量,而是将化学能转换为电能,故D错误.
故选B.
点评 本题考查了反应热与焓变的应用,为高频考点,题目难度中等,明确化学反应与能量变化的关系为解答关键,A为易错点,注意影响焓变的影响,试题培养了学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
7.有关明矾净水原理的探究.
(1)提出问题:明矾在水溶液中能全部离解成自由移动的钾离子、铝离子和硫酸根离子,明矾的净水原理是什么?是谁在起作用?
(2)猜想与假设:明矾溶于水生成的胶状物与铝离子有关,即明矾净水是铝离子的作用.
(3)探究实验:设计实验、实验分析与论证.
完成表格:
(4)总结:由以上实验可知:明矾的净水作用与铝离子有关.
(1)提出问题:明矾在水溶液中能全部离解成自由移动的钾离子、铝离子和硫酸根离子,明矾的净水原理是什么?是谁在起作用?
(2)猜想与假设:明矾溶于水生成的胶状物与铝离子有关,即明矾净水是铝离子的作用.
(3)探究实验:设计实验、实验分析与论证.
完成表格:
| 实验步骤 | 实验现象 | 结论 |
| ①在蒸馏水中加少量明矾,搅拌静置 | 明矾全部溶解 | |
| ②在浑浊的天然水中加少量明矾,搅拌静置 | 有絮状沉淀生成,天然水变澄清 | |
| ③在浑浊的天然水中加少量硫酸,搅拌静置 | ||
| ④在浑浊的天然水中加少量硫酸钾,搅拌静置 | ||
| ⑤在浑浊的天然水中加氯化铝,搅拌静置 | 有絮状沉淀生成,天然水变 澄清 |
5.YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于${\;}_{39}^{89}$Y的说法正确的是( )
| A. | Y 在周期表中的位置是第4周期ⅢB族 | |
| B. | 属于非金属元素 | |
| C. | 核素${\;}_{39}^{89}$Y的质子数与中子数之差为 50 | |
| D. | ${\;}_{39}^{89}$Y和${\;}_{39}^{90}$Y是两种不同的核素 |
12.下列各组物质中,不是按  (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )
 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )| 选项 | A | B | C | D |
| a | HNO2 | CH2=CH2 | NaOH | Fe |
| b | NO | CH3CH2Br | NaHCO3 | FeCl3 |
| c | NO2 | CH3CH2OH | Na2CO3 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
2.温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见表:下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s的平均速率v(Cl2)=0.0016 mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则该反应的△H<0 | |
| C. | 温度为T时,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)<v(逆) | |
| D. | 温度为T时,起始时向容器中充入0.5 mol PCl3和0.5 mol Cl2,达到平衡时,PCl3的转化率小于80% |
9.已知:
①2C(s)+O2(g)=2CO(g)△H=-220kJ•mol-1
②氢气燃烧的能量变化示意图:
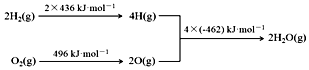
下列说法正确的是( )
①2C(s)+O2(g)=2CO(g)△H=-220kJ•mol-1
②氢气燃烧的能量变化示意图:

下列说法正确的是( )
| A. | C(s)+H2O(g)═CO(g)+H2(g)△H=+130 kJ•mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-480 kJ•mol-1 | |
| C. | C(s)燃烧热为110 kJ•mol-1 | |
| D. | 欲分解2 mol H2O(l),至少需要提供480kJ的热量 |
7.已知:25℃,H2A的电离常数K1=6.0×10-2,K2=6.0×10-5,此温度下,将1mL浓度为0.1mL•L-1的H2A溶液加水稀释到1000mL,下列说法正确的是( )
| A. | 上述稀释过程中,H2A分子及所有离子浓度均减小 | |
| B. | 上述稀释过程中,$\frac{{c(HA}^{-})}{{c(H}_{2}A)}$的变化趋势保持增大 | |
| C. | 上述溶液稀释前后均存在:c(H+)=c(OH-)+2c(A2-) | |
| D. | 根据H2A的电离常数,可推知0.1mol•L-1NaHA溶液的pH值大于7 |