题目内容
6.碳酸钡是一种重要的无机盐产品,广泛应用于工业陶瓷、光学玻璃、建筑等行业.碳化法生产碳酸钡的工艺流程示意图如下:
已知:重晶石的主要成分是BaSO4;Ba(HS)2溶液呈弱碱性;2BaS+2H2O═Ba(OH)2+Ba(HS)2.
回答下列问题:
(1)煅烧时发生反应的化学方程式为BaSO4+2C$\frac{\underline{\;高温\;}}{\;}$BaS+2CO2↑,该反应的氧化产物的电子式为
 ;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).
;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).(2)为了提高浸取速率,可采取的措施是适当提高温度或加快搅拌(任写一种)
(3)碳化时发生反应的离子方程式为CO2+H2O+Ba2++2HS-=BaCO3↓+H2S↑.
(4)脱硫过程是用Na2CO3溶液将BaCO3浆液中含有的BaS2O3除去:CO32-+BaS2O3═BaCO3+S2O32-,该反应的平衡常数为6.4×103[已知Ksp(BaCO3)=2.5×10-9,Ksp(BaS2O3)=1.6×10-5].
(5)Ba(HS)2溶液中离子浓度由大到小的顺序为c(HS-)>c(Ba2+)>c(OH-)>c(H+)>c(S2-),用等式表示溶液中所有离子之间的关系:2c(Ba2+)+c(H+)=c(HS-)+c(OH-)+2c(S2-).
(6)BaCO3不能用于医疗用的“钡餐”,原因是BaCO3与胃酸中的盐酸反应生成可溶性的重金属盐氯化钡会使人中毒.
分析 重晶石和煤粉碎后煅烧粉碎反应生成硫化钡、二氧化碳,尾气主要是一氧化碳,反应后的固体浸取后通入二氧化碳预碳化,加入硫氢化钡溶液反应生成碳酸钡沉淀和硫化氢气体,碳酸钡脱硫后过滤干燥得到碳酸钡产品,
(1)碳酸钡粉碎后煅烧和碳反应生成硫化钡和二氧化碳,氧化产物为二氧化碳,二氧化碳中存在两个碳氧双键,属于共价化合物,当温度过高时,尾气中有毒气体的含量会升高是高温下碳和二氧化碳反应生成有毒气体一氧化碳;
(2)提高浸取速率可以升温、搅拌、粉碎增大接触面积等措施;
(3)碳化时Ba(HS)2和二氧化碳气体发生反应生成碳酸钡沉淀和硫化氢气体;
(4)CO32-+BaS2O3═BaCO3+S2O32-,该反应的平衡常数K=$\frac{c({S}_{2}{{O}_{3}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{c({S}_{2}{{O}_{3}}^{2-})}{c(C{{O}_{3}}^{2-})}$×$\frac{c(B{a}^{2+})}{c(B{a}^{2+})}$=$\frac{Ksp(Ba{S}_{2}{O}_{3})}{Ksp(BaC{O}_{3})}$;
(5)Ba(HS)2溶液中溶质是强碱弱酸盐,HS-离子水解程度大于其电离程度溶液显碱性,溶液中存在电荷守恒;
(6)钡餐的主要成分是硫酸钡,硫酸钡难电离,在溶液中不能电离出有毒的钡离子,不会使人体中毒;碳酸钡能与稀盐酸反应生成可溶性的氯化钡,氯化钡能电离出有毒钡离子.
解答 解:(1)碳酸钡粉碎后煅烧和碳反应生成硫化钡和二氧化碳,反应的化学方程式为:BaSO4+2C$\frac{\underline{\;高温\;}}{\;}$BaS+2CO2↑,反应中碳元素化合价升高失电子做还原剂被氧化得到氧化产物二氧化碳,二氧化碳中存在两个碳氧双键,属于共价化合物,电子式为: ,
,
故答案为:BaSO4+2C$\frac{\underline{\;高温\;}}{\;}$BaS+2CO2↑; ;
;
(2)提高浸取速率可以升温、搅拌、粉碎增大接触面积等措施,
故答案为:升温或搅拌;
(3)碳化时Ba(HS)2和H2S气体粉碎反应生成碳酸钡沉淀和硫化氢气体,反应的离子方程式为:CO2+H2O+Ba2++2HS-=BaCO3↓+H2S↑,
故答案为:CO2+H2O+Ba2++2HS-=BaCO3↓+H2S↑;
(4)CO32-+BaS2O3═BaCO3+S2O32-,该反应的平衡常数K=$\frac{c({S}_{2}{{O}_{3}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{c({S}_{2}{{O}_{3}}^{2-})}{c(C{{O}_{3}}^{2-})}$×$\frac{c(B{a}^{2+})}{c(B{a}^{2+})}$=$\frac{Ksp(Ba{S}_{2}{O}_{3})}{Ksp(BaC{O}_{3})}$=$\frac{1.6×1{0}^{-5}}{2.5×1{0}^{-9}}$=6.4×103,
故答案为:6.4×103;
(5)Ba(HS)2溶液中溶质是强碱弱酸盐,HS-离子水解程度大于其电离程度溶液显碱性,溶液中离子浓度大小为:c(HS-)>c(Ba2+)>c(OH-)>c(H+)>c(S2-),溶液中存在电荷守恒2c(Ba2+)+c(H+)=c(HS-)+c(OH-)+2c(S2-),
故答案为:c(HS-)>c(Ba2+)>c(OH-)>c(H+)>c(S2-);2c(Ba2+)+c(H+)=c(HS-)+c(OH-)+2c(S2-);
(6)碳酸钡与稀盐酸反应生成氯化钡、水和二氧化碳,该反应的化学方程式为:BaCO3+2HCl=BaCl2+CO2↑+H2O,BaCO3与胃酸中的盐酸反应生成可溶性的重金属盐氯化钡会使人中毒,
故答案为:BaCO3与胃酸中的盐酸反应生成可溶性的重金属盐氯化钡会使人中毒.
点评 本题考查了物质制备工艺流程分析,主要是程度溶解平衡常数计算、电解质溶液中离子浓度大小比较、电荷守恒等知识点,掌握基础是解题关键,题目难度中等.

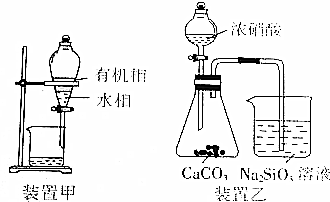
| A. | 制备Fe(OH)3胶体:向0.1mol•L-1FeCl3溶液中加适量NaOH溶液并煮沸片刻 | |
| B. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| C. | 用装置乙进行实验,证明酸性:硝酸>碳酸>硅酸 | |
| D. | 探讨改变浓度研究反应“2Fe3++2I-?2Fe2++I2”中Fe3+和Fe2+的相互转化:向3mL 0.05mol•L-1Fe2(SO4)3溶液中加入3 mL 0.01mol•L-1 KI溶液,将所得黄色溶液等分成三份,第一份加入数滴0.01 mol•L-1AgNO3溶液,第二份加入1mL0.01mol•L-1FeSO4溶液,第三份加1mL水,观察并比较实验现象 |
已知:
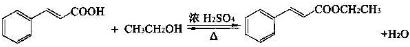
| 名称 | 相对分子质量 | 原色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 肉桂酸 | 148 | 白色晶体 | 300 | 1.2475 |
| 肉桂酸乙酯 | 176 | 无色油状液体 | 271.5 | 1.0491 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
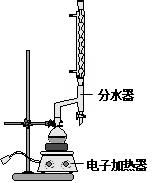
①在圆底烧瓶中加入14.80g肉桂酸,25mL95%的乙醇,20mL环己烷和4mL浓硫酸,混合均匀并加入沙粒,加热回流2h,至分水器中水层不再明显增加,停止加热,冷却至室温.
②将烧瓶内反应液倒入盛有适量水的烧杯中,加入Na2CO3,用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层,加入少量无水MgSO4固体,静置,过滤,对滤液进行蒸馏,低温蒸出乙醇、乙醚和环已烷后,继续升温,接收271~273℃的馏分.
③检验合格后,测得产品质量为13.60g.
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最合适的是C(填入正确选项前的字母)
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中控制加热回流温度的范围A(填入正确选项前的字母)
A.65~70℃B.78.3~80.8℃C.80.8~271.5℃D.271.5~300℃
(3)步骤②中加入NaCO3的作用是除去过量的硫酸和肉桂酸,加入无水MgSO4固体的作用是除去产品中微量的水.
(4)关于该实验的操作叙述正确的是B.
A.冷凝管中的冷却水从上口进下口出,与管内蒸气形成逆流
B.使用分水器时,先加水接近支管口,随着加热回流,及时打开活塞放出少量的水
C.萃取操作时,振荡过程中需要放气,放气是通过打开分液漏斗上口的玻璃塞进行的
D.静置分层后,打开活塞,先放出有机层,再弃去水层
(5)检验产品中是否含有肉桂酸的方法取少量粗产品固体溶于水,测溶于的pH.
(6)计算肉桂酸乙酯的产率77.27%.
| A. | 加热后固体发黑 | B. | 坩埚沾有受热不分解的杂质 | ||
| C. | 加热时有少量晶体溅出 | D. | 晶体中混有受热不分解的杂质 |
| A. | 标准状况下,2.24L戊烷中存在的共价键总数为1.6NA | |
| B. | 23gNO2与N2O4的混合气体中含有的氮原子数为0.5NA | |
| C. | 过氧化钠与二氧化碳反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 1L0.1mol•L-1的NaH2PO4溶液中H2PO4-、HPO42-和PO43-离子数之和为0.1NA |
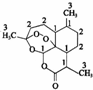 我国药学家屠呦呦教授因发现并提纯青蒿素而获得2015 年诺贝尔奖.青蒿素是用于治疗疟疾的药物,其结构简式如图:下列有关青蒿素的叙述正确的是( )
我国药学家屠呦呦教授因发现并提纯青蒿素而获得2015 年诺贝尔奖.青蒿素是用于治疗疟疾的药物,其结构简式如图:下列有关青蒿素的叙述正确的是( )| A. | 分子式为 C15H2205 | B. | 有较强的还原性,能杀死疟原虫 | ||
| C. | 易溶于水、酒精等溶剂 | D. | 能发生取代反应和加成反应 |
| A. | 相同物质的量浓度的Na2Y和NaHY溶液,前者的pH大于后者 | |
| B. | NaHY的溶液中,离子浓度大小顺序为:c(Na+)>c(Y-)>c(HY-)>c(OH-)>c(H+) | |
| C. | HY-的水解离子方程式为:HY-+H2O?Y-+H3O+ | |
| D. | 在Na2Y、NaHY、H2Y的溶液中,阴离子的种类不同 |

 .
.
 ,名称为2,3-二甲基-2-丁烯.A中的碳原子是否都处于同一平面?是(填“是”或“不是”).
,名称为2,3-二甲基-2-丁烯.A中的碳原子是否都处于同一平面?是(填“是”或“不是”).