题目内容
16.某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢.A的结构简式为
 ,名称为2,3-二甲基-2-丁烯.A中的碳原子是否都处于同一平面?是(填“是”或“不是”).
,名称为2,3-二甲基-2-丁烯.A中的碳原子是否都处于同一平面?是(填“是”或“不是”).
分析 A的相对分子质量为84,根据商余法可得:$\frac{84}{14}$=6,A的化学式为C6H12,由于A分子中含有碳碳双键,则A为单烯烃己烯,又核磁共振氢谱表明分子中只有一种类型的氢,故A的结构简式为: ,根据烯烃的命名原则写出其名称;结合乙烯、甲烷的空间结构判断该有机物分子中C原子是否共平面.
,根据烯烃的命名原则写出其名称;结合乙烯、甲烷的空间结构判断该有机物分子中C原子是否共平面.
解答 解:A的相对分子质量为84,根据商余法可得:$\frac{84}{14}$=6,A的化学式为C6H12,由于A分子中含有碳碳双键,则A为单烯烃己烯,又核磁共振氢谱表明分子中只有一种类型的氢,故A的结构简式为: ,A分子中碳碳双键在2号C,甲基在2、3号C,则其名称为:2,3-二甲基-2-丁烯;
,A分子中碳碳双键在2号C,甲基在2、3号C,则其名称为:2,3-二甲基-2-丁烯;
由于碳碳双键是平面型结构,而4个甲基与不饱和碳原子又直接相连,所以6个碳原子处于同一平面上,
故答案为: ;2,3-二甲基-2-丁烯;是.
;2,3-二甲基-2-丁烯;是.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握判断有机物空间结构的方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
1.已知:1molICl(s)被H2(g)完全还原为I2(s)和HCl(g)时,放出109kJ的热量,反应机理如下:
①H2+ICl→HI+HCl 慢反应
②HI+ICl→I2+HCl 快反应
下列说法正确的是( )
①H2+ICl→HI+HCl 慢反应
②HI+ICl→I2+HCl 快反应
下列说法正确的是( )
| A. | ICl中I显-1价 | |
| B. | HI是反应的中间产物 | |
| C. | 总反应速率的快慢主要由反应②决定 | |
| D. | 总反应的热化学方程式为H2(g)+2ICl(s)=I2(s)+2HCl(g)△H=-109kJ•mol-1 |
5.A、B、C、D、E、F六种短周期元素的原子序数依次增大.A、D同族,B、C同周期;C是F不同周期的邻族元素;B原子最外层电子数比其次外层电子数多2;B、A两元素的核电荷数之差等于它们的原子最外层电子数之和;E和F的原子序数之和为30.由上述六种元素中的两种元素组成的甲、乙、丙、丁、戊、己六种化合物如表所示:
请回答下列问题:
(1)化合物己的化学式为CCl4,每个乙分子含有1个非极性键.
(2)向含有1mol乙的水溶液中加入MnO2,该反应中电子转移的物质的量为1mol.
(3)丙分子的结构式为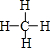 .
.
(4)戊在水溶液中电离出的阳离子的结构示意图为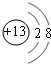 .
.
(5)丁与水发生反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.
| 化合物 | 甲 | 乙 | 丙 |
| 各元素原子个数比 | N(A):N(C)=2:1 | N(A):N(C)=1:1 | N(B):N(A)=1:4 |
| 化合物 | 丁 | 戊 | 己 |
| 各元素原子个数比 | N(D):N(C)=1:1 | N(E):N(F)=1:3 | N(B):N(F)=1:4 |
(1)化合物己的化学式为CCl4,每个乙分子含有1个非极性键.
(2)向含有1mol乙的水溶液中加入MnO2,该反应中电子转移的物质的量为1mol.
(3)丙分子的结构式为
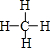 .
.(4)戊在水溶液中电离出的阳离子的结构示意图为
 .
.(5)丁与水发生反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.
6.某有机物结构简式为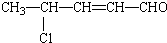 ,该有机物可能发生的反应( )
,该有机物可能发生的反应( )
①氧化 ②取代 ③加成 ④消去 ⑤还原 ⑥酯化 ⑦水解 ⑧加聚.
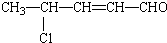 ,该有机物可能发生的反应( )
,该有机物可能发生的反应( )①氧化 ②取代 ③加成 ④消去 ⑤还原 ⑥酯化 ⑦水解 ⑧加聚.
| A. | ①②③④⑦⑧ | B. | ①②③④⑤⑦⑧ | C. | ①②③④⑤⑦ | D. | ②③④⑤⑦⑧ |

 ;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).
;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示). 分子式为CmH20的烷烃中m为9,分子中含有22个共价键的烷烃的分子式:C7H16,与CO2的密度(同温同压)相同的烷烃分子式为的C3H8.若上述四种烃各为1mol,在足量O2中燃烧,消耗O2最多的是(填分子式)C9H20.
分子式为CmH20的烷烃中m为9,分子中含有22个共价键的烷烃的分子式:C7H16,与CO2的密度(同温同压)相同的烷烃分子式为的C3H8.若上述四种烃各为1mol,在足量O2中燃烧,消耗O2最多的是(填分子式)C9H20.
 .
. .
.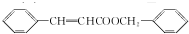 ,下列关于X的说法不正确的是bc(填字母).
,下列关于X的说法不正确的是bc(填字母). 或
或 (填结构简式).
(填结构简式).