题目内容
14.下列实验方案能达到实验目的是( )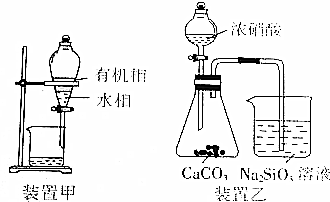
| A. | 制备Fe(OH)3胶体:向0.1mol•L-1FeCl3溶液中加适量NaOH溶液并煮沸片刻 | |
| B. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| C. | 用装置乙进行实验,证明酸性:硝酸>碳酸>硅酸 | |
| D. | 探讨改变浓度研究反应“2Fe3++2I-?2Fe2++I2”中Fe3+和Fe2+的相互转化:向3mL 0.05mol•L-1Fe2(SO4)3溶液中加入3 mL 0.01mol•L-1 KI溶液,将所得黄色溶液等分成三份,第一份加入数滴0.01 mol•L-1AgNO3溶液,第二份加入1mL0.01mol•L-1FeSO4溶液,第三份加1mL水,观察并比较实验现象 |
分析 A.氢氧化铁胶体制备:向沸水中滴加几滴饱和的氯化铁溶液,加热至液体呈红褐色为止;
B.分液时,下层液体从下口倒出,上层液体从上口倒出;
C.强酸能和弱酸盐反应生成弱酸;
D.将0.2mol•L-1的KI溶液和0.05mol•L-1 Fe2(SO4)3溶液等体积混合后,若此反应不可逆,则Fe3+和I-能恰好完全反应,则溶液中无Fe3+和I-,故只需要证明溶液中含Fe3+和I-,则即能证明此反应为可逆反应,存在化学平衡.
解答 解:A.氢氧化铁胶体制备:向沸水中滴加几滴饱和的氯化铁溶液,加热至液体呈红褐色为止,氯化铁和NaOH反应生成氢氧化铁沉淀而得不到胶体,故A错误;
B.分液时,下层液体从下口倒出,上层液体从上口倒出,否则易产生杂质,故B错误;
C.强酸能和弱酸盐反应生成弱酸,硝酸具有挥发性,导致生成的二氧化碳中含有硝酸,硝酸也能和硅酸钠反应生成硅酸而干扰二氧化碳的检验,故C错误;
D.将0.2mol•L-1的KI溶液和0.05mol•L-1 Fe2(SO4)3溶液等体积混合后,若此反应不可逆,则Fe3+和I-能恰好完全反应,则溶液中无Fe3+和I-,故只需要证明溶液中含Fe3+和I-,则即能证明此反应为可逆反应,存在化学平衡,第一份加入数滴0.01 mol•L-1AgNO3溶液产生黄色沉淀,平衡逆向移动,溶液褪色;第二份加入1mL0.01mol•L-1FeSO4溶液,亚铁离子浓度增大,平衡逆向移动,溶液颜色变浅,第三份加1mL水,溶液颜色变浅,但比第二份略深,通过对比实验能证明存在可逆反应,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、实验操作、酸性强弱判断、可逆反应等知识点,明确实验原理及物质性质、实验基本操作方法是解本题关键,注意C中要防止硝酸的干扰,易错选项是D.

 名校课堂系列答案
名校课堂系列答案| A. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA | |
| B. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| C. | 4℃时,18g 2H216O中含有共用电子对数为2NA | |
| D. | 常温下,4gCH4含有NA 个C-H共价键 |
| 元素编号 | 元素特征信息 |
| A | 是原子半径最小的元素 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 是短周期元素中原子半径最大的主族元素. |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
| F | 原子有三个电子层,且最外层电子数是最内层电子数的3倍, |
(2)写出C与B 形成的两种离子化合物的化学式Na2O;Na2O2.
(3)写出B与A 形成的两种化合物的电子式
 ;
;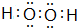 .
.(4)含B、C、F 三种元素的化合物有Na2SO4、Na2SO3(请填写具体的化学式,至少2种).
(5)D单质和C的最高价氧化物对应水化物水溶液反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑.
(6)FB2和E元素的单质在水溶液中反应的化学方程式是SO2+Cl2+2H2O=2HCl+H2SO4.
(7)D的单质和氧化铁反应可用于野外焊接钢轨,该反应属于放热 (填“吸热”或“放热”)反应,写出反应的化学方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
| A. | 酸式滴定管 | B. | 锥形瓶 | C. | 碱式滴定管 | D. | 以上均不正确 |
| A. | 酸式滴定管在装酸液前用标准盐酸溶液润洗2~3次 | |
| B. | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | |
| C. | 酸式滴定管读数时,滴定前正确读数,滴定后俯视读数 | |
| D. | 盛NaOH溶液的锥形瓶滴定前未干燥,带有水珠 |
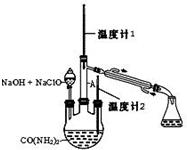 水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:
水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:
 ;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).
;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).