题目内容
6.固体AgCl在水中、在0.01mol/LNaCl溶液中和在0.05mol/LAgNO3溶液中的溶解度分别为S1、S2、S3,则有( )| A. | S1>S2>S3 | B. | S2>S1>S3 | C. | S3>S2>S1 | D. | S2>S3>S1 |
分析 AgCl饱和溶液中存在溶解平衡:AgCl(aq)?Ag+(aq)+Cl-(aq),AgCl的溶解度大小取决于溶液中c(Ag+)或c(Cl-)的大小,c(Ag+)或c(Cl-)越答,AgCl的溶解度越小,从平衡移动的角度进行分析即可.
解答 解:AgCl饱和溶液中存在溶解平衡:AgCl(aq)?Ag+(aq)+Cl-(aq),
在0.01mol/LNaCl溶液中,c(Cl-)=0.01mol/L,抑制了AgCl的溶解,降低了溶解度,因此S2<S1,
在0.05mol/LAgNO3溶液中,c(Ag+)=0.05mol/L,抑制了AgCl的溶解,降低了溶解度,因此S3<S1,
因为c(Ag+)=0.05mol/L>c(Cl-)=0.01mol/L,所以0.05mol/LAgNO3溶液对AgCl的溶解的抑制作用更强,因此S3<S2,
故选A.
点评 本题考查难溶电解质的溶解平衡,题目难度不大,注意掌握难溶电解质的溶解平衡的含义及其影响因素,明确溶液中含有的氯离子或银离子浓度越大,氯化银的溶解度越小.

练习册系列答案
相关题目
16.类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否.下表中有关推论正确的是( )
| 已知事实 | 推论 | |
| A | 氯乙烷能发生消去反应 | 所有的卤代烃都能发生消去反应 |
| B | 乙烯分子内所有原子在同一平面上 | 丙烯分子内所有原子在同一平面上 |
| C | 乙烯在空气中燃烧有黑烟 | 苯在空气中燃烧产生的烟更浓 |
| D | 烷烃的含碳量随碳原子数的增大而增大 | 炔烃的含碳量随碳原子数的增大而增大 |
| A. | A | B. | B | C. | C | D. | D |
17.下列化学用语表达不正确的是( )
| A. | HClO的结构式为:H-O-Cl | B. | 水的电子式为:H:O:H | ||
| C. | Cl-的离子结构示意图为: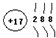 | D. | 甲烷的化学式为:CH4 |
1.下列化学反应的离子方程式正确的是( )
| A. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| B. | 用往氯化铁中加铁粉:Fe+Fe3+═2Fe2+ | |
| C. | 往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| D. | 往碳酸镁中滴加稀盐酸:MgCO3+2H+═CO2↑+H2O+Mg2+ |
11.下列各组离子,在某无色透明的酸性溶液中,能大量共存的离子组是( )
| A. | K+、Na+、SO4-、HCO3- | B. | K+、Cu2+、SO4-、NO3- | ||
| C. | K+、Na+、Cl-、NO3- | D. | K+、Fe3+、NO3-、Cl- |
18.已知苯的n溴代物和m溴代物的种类数相等(m≠n),则n和m的关系是( )
| A. | m+n=6 | B. | m+n=4 | C. | m+n=8 | D. | 无法确定 |
15.W、R、X、Y的原子序数依次增大,Y的最高正价和最低负价之和等于0,L层上电子数是M层上电子数的2倍;在常温常压下,仅由W和R元素组成的两种化合物之间能相互转化,且转化过程中没有电子的转移;这4种元素的最外层电子数之和等于R原子的核电荷数的2倍,下列说法正确的是( )
| A. | 元素的非金属性强弱顺序为R>Y>W | |
| B. | R与其他三种元素元能形成共价化合物 | |
| C. | 简单氢化物的热稳定性次序为R>W>Y | |
| D. | 原子半径大小顺序为W>R>X>Y |