题目内容
18.完成下列问题(1)医疗上,用碳酸氢钠治疗胃酸过多的原理(用离子方程式表示)HCO3-+H+═H2O+CO2↑;
(2)氯碱工业的反应原理(又为氯气的工业制法)(用化学方程式表示):2NaCl+2 H2O$\frac{\underline{\;通电\;}}{\;}$=Cl2↑+H2↑+2NaOH;
(3)用过氧化钠作为呼吸面具的供氧剂与二氧化碳反应的原理(用化学方程式表示)2Na2O2+2CO2═2Na2CO3+O2;
(4)写出用铜与氯化铁反应印刷电路板的原理(用离子方程式表示)Cu+2Fe3+═2Fe2++Cu2+;
该反应中Fe3+是氧化剂(填写化学式),氧化产物为Cu2+(填写化学式),当反应中转移4mol电子时,溶液质量增加128g.
(5)配平下列反应的方程式,并标出电子转移的方向和数目:
1SO2+2H2S═3S↓+2H2O.
分析 (1)碳酸氢钠具有弱碱性,与盐酸反应生成氯化钠、二氧化碳与水,可以治疗胃酸过多;
(2)电解氯化钠溶液得到氯气、氢气和氢氧化钠;
(3)二氧化碳与过氧化钠反应生成生成碳酸钠和氧气;
(4)铜与氯化铁反应生成氯化铜和氯化亚铁,反应中Cu的化合价升高,Fe的化合价降低;根据转移电子与质量的关系计算;
(5)反应2H2S+SO2═3S↓+2H2O中硫元素的化合价变化为:由+4价、-2价分别变为0价.
解答 解:(1)碳酸氢钠具有弱碱性,与盐酸反应生成氯化钠、二氧化碳与水,反应离子方程式为HCO3-+H+=H2O+CO2↑,故可以治疗胃酸过多,
故答案为:HCO3-+H+=H2O+CO2↑;
(2)电解氯化钠溶液得到氯气、氢气和氢氧化钠,其化学方程式为:2NaCl+2 H2O$\frac{\underline{\;通电\;}}{\;}$=Cl2↑+H2↑+2NaOH;
故答案为:2NaCl+2 H2O$\frac{\underline{\;通电\;}}{\;}$=Cl2↑+H2↑+2NaOH;
(3)二氧化碳与过氧化钠反应生成生成碳酸钠和氧气,其化学方程式为:2Na2O2+2CO2═2Na2CO3+O2;
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(4)铜与氯化铁反应生成氯化铜和氯化亚铁,则离子方程式为:Cu+2Fe3+═2Fe2++Cu2+,反应中Cu的化合价升高被氧化,则Cu2+是氧化产物,Fe的化合价降低被还原,所以Fe3+作氧化剂;当反应中转移4mol电子时,Cu溶解了2mol,则溶液的质量增加2mol×64g/mol=128g;
故答案为:Cu+2Fe3+═2Fe2++Cu2+;Fe3+;Cu2+;128g;
(5)反应中H2S中S氧化化合价升高,由-2价升高到0价,SO2中S元素化合价降低,由+4价降低到0价,氧化还原反应反应中得失电子数目相等,表现为化合价升降的总数相等,为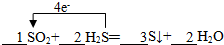 ,故答案为:
,故答案为: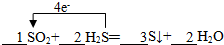 .
.
点评 本题考查较为综合,全面考查氧化还原反应知识,注意把握元素化合价的变化,明确电子转移的数目和方向,根据化合价的升降总数计算电子转移的数目,题目难度中等.

| A. | 硝酸钠和金刚石 | B. | 晶体硅和水晶(SiO2) | ||
| C. | 水晶(SiO2)和干冰 | D. | NaCl和 I2 |
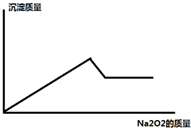 某溶液中,可能含有Al3+、Fe3+、K+、Mg2+、Fe2+、Cu2+中的一种或几种,现加入过氧化钠只产生无色无味的气体 并同时析出白色沉淀,加入过氧化钠的量与产生沉淀的量之间的关系如图
某溶液中,可能含有Al3+、Fe3+、K+、Mg2+、Fe2+、Cu2+中的一种或几种,现加入过氧化钠只产生无色无味的气体 并同时析出白色沉淀,加入过氧化钠的量与产生沉淀的量之间的关系如图
 Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.