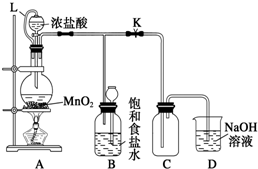
题目内容
17.下列叙述正确的是( )| A. | 二氧化硅是酸性氧化物,不与任何酸反应 | |
| B. | 因为CO2通入水玻璃中可制得硅酸,说明碳酸的酸性比硅酸酸性强 | |
| C. | SiO2是制造光导纤维的材料,SiO2晶体中,每个硅原子与两个氧原子相连 | |
| D. | 工业上制玻璃的主要原料有:黏土、石灰石、石英 |
分析 A.二氧化硅能够与氢氟酸反应;
B.依据强酸制备弱酸规律解答;
C.原子晶体中非金属原子之间的作用力为共价键,Si原子能形成4个共价键;
D.根据制玻璃的原料分析.
解答 解:A.二氧化硅是酸性氧化物,常温下能够与氢氟酸反应,故A错误;
B.碳酸酸性强于硅酸,所以为CO2通入水玻璃中可制得硅酸,故B正确;
C.SiO2晶体中每个硅原子能形成4个共价键,则每个Si与4个氧原子以共价键相结合,故C错误;
D.工业上制玻璃的主要原料有:纯碱、石灰石、石英,没有黏土,故D错误;
故选:B.
点评 本题考查了Si及其化合物的结构和性质,注意把握二氧化硅的性质和Si的成键特点,题目难度不大.

练习册系列答案
相关题目
15.W、R、X、Y的原子序数依次增大,Y的最高正价和最低负价之和等于0,L层上电子数是M层上电子数的2倍;在常温常压下,仅由W和R元素组成的两种化合物之间能相互转化,且转化过程中没有电子的转移;这4种元素的最外层电子数之和等于R原子的核电荷数的2倍,下列说法正确的是( )
| A. | 元素的非金属性强弱顺序为R>Y>W | |
| B. | R与其他三种元素元能形成共价化合物 | |
| C. | 简单氢化物的热稳定性次序为R>W>Y | |
| D. | 原子半径大小顺序为W>R>X>Y |
5.将二氧化碳通入到下列溶液中,不能发生反应的是( )
| A. | CaCl2 | B. | Na2CO3 | C. | Na2SiO3 | D. | NaOH |
12.下列物质为纯净物的是( )
| A. | 水泥 | B. | 水玻璃 | C. | 氨水 | D. | 液氯 |
7.氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质.下列各组物质熔化时所克服的微粒间的作用力与氮化硼熔化时所克服的微粒间的作用力都相同的是( )
| A. | 硝酸钠和金刚石 | B. | 晶体硅和水晶(SiO2) | ||
| C. | 水晶(SiO2)和干冰 | D. | NaCl和 I2 |

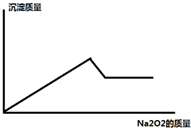 某溶液中,可能含有Al3+、Fe3+、K+、Mg2+、Fe2+、Cu2+中的一种或几种,现加入过氧化钠只产生无色无味的气体 并同时析出白色沉淀,加入过氧化钠的量与产生沉淀的量之间的关系如图
某溶液中,可能含有Al3+、Fe3+、K+、Mg2+、Fe2+、Cu2+中的一种或几种,现加入过氧化钠只产生无色无味的气体 并同时析出白色沉淀,加入过氧化钠的量与产生沉淀的量之间的关系如图