题目内容
7.在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:| 加入盐酸积V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 测得溶液温度/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
(1)写出上述反应的化学方程式NaOH+HCl═NaCl+H2O,该反应属于放热(“吸热”或“放热”)反应;
(2)当加入盐酸体积为8mL时,溶液的pH大于7;
(3)当加入盐酸l0mL以上,溶液温度逐渐下降的原因是:过量盐酸起冷却降温作用,反应停止热量散失.
分析 (1)盐酸和氢氧化钠溶液反应生成了氯化钠和水,根据题中的表格数据可以知道,开始加入稀盐酸时溶液的温度是升高的,所以可以判断该反应为放热反应,可以据此解答该题;
(2)从表格中可以知道,加入到10mL时溶液的我温度依然升高,可以判断加入8mL稀盐酸后溶液中仍有氢氧化钠,所以溶液呈碱性,其pH值大于7,可以据此解答该题;
(3)当加入盐酸l0mL以上溶液温度降低,说明氢氧化钠已被消耗完毕,反应停止,热量散失,可以据此解答该题.
解答 解:(1)盐酸和氢氧化钠溶液反应生成了氯化钠和水,该反应的化学方程式为:NaOH+HCl═NaCl+H2O;根据题中的表格数据可以知道,开始加入稀盐酸时溶液的温度是升高的,所以可以判断该反应为放热反应,
故答案为:NaOH+HCl═NaCl+H2O;放热;
(2)从表格中可以知道,加入到10mL时溶液的我温度依然升高,可以判断加入8mL稀盐酸后溶液中仍有氢氧化钠,所以溶液呈碱性,其pH值大于7,
故答案为:大于;
(3)当加入盐酸l0mL以上溶液温度降低,说明氢氧化钠已被消耗完毕,反应停止,热量散失.
故答案为:过量盐酸起冷却降温作用,反应停止热量散失.
点评 本题考查了化学反应速率和化学反应能量变化的分析,掌握中和反应的概念“酸碱发生的反应”及其应用,主要是物质发生化学变化时的能量变化和中和放热的理解应用.题目难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
4.下列说法中正确的是( )
| A. |  的名称:2-甲基乙醇 的名称:2-甲基乙醇 | B. | 聚丙烯的链节: | ||
| C. | 甲酸甲酯的结构简式:C2H4O2 | D. | 比例模型为 的分子可发生加成反应 的分子可发生加成反应 |
5.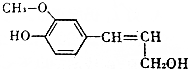 木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法正确的是( )
木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法正确的是( )
 木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法正确的是( )
木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法正确的是( )| A. | 该物质的分子式是C10H15O3,属于芳香族化合物 | |
| B. | 1mol该物质最多能与1molH2发生加成反应 | |
| C. | 1mol该物质只能与1molBr2反应 | |
| D. | 该物质可以与FeCl3溶液发生显色反应,也能发生酯化反应 |
2.将二氧化硫通入氯水中,所得溶液的pH比原来氯水溶液的pH( )
| A. | 大 | B. | 小 | ||
| C. | 相同 | D. | 可能变大也可能变小 |
19.已知在相同状况下,要使同一化学键断裂需要吸收的能量等于形成该化学键放出的能量.下列说法正确的是( )
| A. | 电解熔融的Al2O3可以制得金属铝和氧气,该反应是一个放出能量的反应 | |
| B. | 水分解产生氢气和氧气时放出能量 | |
| C. | 相同状况下,反应2CO+O2═2CO2是一个放热反应,则反应2CO2═2CO+O2是一个吸热反应 | |
| D. | 氯化氢分解成氢气和氯气时需要吸收能量,实验氯化氢的总能量高于氢气和氯气的总能量 |
16.煤化工中两个重要反应为①C(s)+H2O(g)?H2(g)+CO(g)
△H=+131.3kJ•mol-1,②CO(g)+H2O(g)$?_{△}^{催化剂}$CO2(g)+H2(g).
(1)下列说法正确的是A.
A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度
B.反应②的熵变△S>0
C.反应①中增加C固体的量能增大反应速率
D.在反应②中及时分离出产生的H2对正反应速率无影响
(2)若工业上要增加反应①的速率,最经济的措施为粉碎煤炭、增加H2O(g)的浓度、使用合适的催化剂.
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如下三组数据:
①实验Ⅰ中,从反应开始到反应达到平衡时,H2O(g)的平均反应速率为0.16mol•L-1•min-1.
②CO(g)和H2O(g)反应的△H小于0(填“大于”“小于”或“等于”).
③实验Ⅲ中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b,与实验Ⅱ相比,化学平衡常数不变(填“增大”“减小”或“不变”).
④若在900℃时,实验Ⅱ反应达到平衡后,向此容器中再加入1mol CO、0.5mol H2O、0.2mol CO2、0.5mol H2,平衡正反应方向移动(填“向正反应方向移动”“向逆反应方向移动”“不移动”).
(4)CO、H2可用于生产甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-mkJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-nkJ•mol-1
反应③:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H<0
则m与n的关系为n>2m.
△H=+131.3kJ•mol-1,②CO(g)+H2O(g)$?_{△}^{催化剂}$CO2(g)+H2(g).
(1)下列说法正确的是A.
A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度
B.反应②的熵变△S>0
C.反应①中增加C固体的量能增大反应速率
D.在反应②中及时分离出产生的H2对正反应速率无影响
(2)若工业上要增加反应①的速率,最经济的措施为粉碎煤炭、增加H2O(g)的浓度、使用合适的催化剂.
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如下三组数据:
| 实验 组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| Ⅰ | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
| Ⅲ | 900 | a | b | c | d | t |
②CO(g)和H2O(g)反应的△H小于0(填“大于”“小于”或“等于”).
③实验Ⅲ中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b,与实验Ⅱ相比,化学平衡常数不变(填“增大”“减小”或“不变”).
④若在900℃时,实验Ⅱ反应达到平衡后,向此容器中再加入1mol CO、0.5mol H2O、0.2mol CO2、0.5mol H2,平衡正反应方向移动(填“向正反应方向移动”“向逆反应方向移动”“不移动”).
(4)CO、H2可用于生产甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-mkJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-nkJ•mol-1
反应③:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H<0
则m与n的关系为n>2m.
17.下列说法不正确的是( )
| A. | Na2O2可用于呼吸面具中氧气的来源 | |
| B. | NaHCO3的热稳定性大于Na2CO3 | |
| C. | 乙醇可与金属钠反应放出氢气 | |
| D. | 金属钠着火时,可用细沙覆盖灭火 |
 HSO3-+OH-,所以滴入酚酞后溶液变红,在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.
HSO3-+OH-,所以滴入酚酞后溶液变红,在该溶液中加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.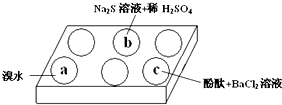
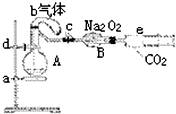 如图所示装置中,a是盛有标况下224mL空气(氧气占五分之一)和10mL 1.2mol/L硝酸的烧瓶,b是未充气(实验开始前内部没有气体)装有0.384g铜粉的气球,c是夹紧了的弹簧夹,d中盛有足量的过氧化钠,e是充有二氧化碳的注射器.整套装置经过气密性检查已合格.
如图所示装置中,a是盛有标况下224mL空气(氧气占五分之一)和10mL 1.2mol/L硝酸的烧瓶,b是未充气(实验开始前内部没有气体)装有0.384g铜粉的气球,c是夹紧了的弹簧夹,d中盛有足量的过氧化钠,e是充有二氧化碳的注射器.整套装置经过气密性检查已合格.