题目内容
2.将二氧化硫通入氯水中,所得溶液的pH比原来氯水溶液的pH( )| A. | 大 | B. | 小 | ||
| C. | 相同 | D. | 可能变大也可能变小 |
分析 二氧化硫通入氯水中发生Cl2+SO2+2H2O=H2SO4+2HCl,酸性增强,以此来解答.
解答 解:二氧化硫通入氯水中发生Cl2+SO2+2H2O=H2SO4+2HCl,弱酸转化为强酸,电离出氢离子浓度增大,酸性增强,所得溶液的pH比原来氯水溶液的pH小,
故选B.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意酸性越强对应pH越小,题目难度不大.

练习册系列答案
相关题目
10.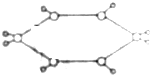 已知某烃的球棍模型如图所示,图中“-”代表单键或双键,则下列有关烃的说法中正确的是( )
已知某烃的球棍模型如图所示,图中“-”代表单键或双键,则下列有关烃的说法中正确的是( )
 已知某烃的球棍模型如图所示,图中“-”代表单键或双键,则下列有关烃的说法中正确的是( )
已知某烃的球棍模型如图所示,图中“-”代表单键或双键,则下列有关烃的说法中正确的是( )| A. | 属于芳香烃 | B. | 常温常压下为气体 | ||
| C. | 该烃的一氯代物有四种 | D. | 能使溴的四氯化碳溶液褪色 |
7.甲醇和正丙醇是两种常见的液态有机物,它们的某些物理性质如下表所示.据此,请判断将甲醇和正丙醇的混合物进行分离的最佳方法是( )
| 物质 | 熔点 | 沸点 | 密度 | 溶解性 |
| 甲醇 | -97.8℃ | 64.8℃ | 0.791g•mL-1 | 易溶于水、乙醇、正丙醇 |
| 正丙醇 | -126.5℃ | 97.4℃ | 0.804g•mL-1 | 能跟水、甲醇、乙醇以任意比互溶 |
| A. | 萃取 | B. | 过滤 | C. | 蒸发 | D. | 蒸馏 |
7.在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:
根据上表分析:
(1)写出上述反应的化学方程式NaOH+HCl═NaCl+H2O,该反应属于放热(“吸热”或“放热”)反应;
(2)当加入盐酸体积为8mL时,溶液的pH大于7;
(3)当加入盐酸l0mL以上,溶液温度逐渐下降的原因是:过量盐酸起冷却降温作用,反应停止热量散失.
| 加入盐酸积V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 测得溶液温度/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
(1)写出上述反应的化学方程式NaOH+HCl═NaCl+H2O,该反应属于放热(“吸热”或“放热”)反应;
(2)当加入盐酸体积为8mL时,溶液的pH大于7;
(3)当加入盐酸l0mL以上,溶液温度逐渐下降的原因是:过量盐酸起冷却降温作用,反应停止热量散失.
4.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | lmol的Na2CO3溶于盐酸形成混合溶液1L,常温下在pH=4时,c(CO32-)+c(HCO3-)+c(H2CO3)=0.lmol/L | |
| B. | 标准状况下,2.24 L一氯甲烷中含有氢原子数目为0.3NA | |
| C. | 等物质的量的O2和CO2所含氧原子数均为2NA | |
| D. | 6.8 g熔融的KHSO4中含有0.1 NA个阳离子 |
5.常温下,在pH值为4的FeCl3溶液、pH值为10的Na2CO3溶液和pH值为2的盐酸溶液中,水的电离度分别为α1、α2和α3,则它们的关系为( )
| A. | α1=α2>α3 | B. | α1<α2<α3 | C. | α1>α2>α3 | D. | 无法判断 |
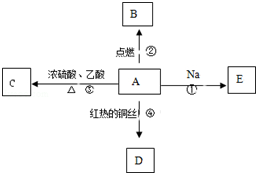 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.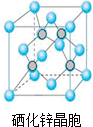 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.
硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.