��Ŀ����
12��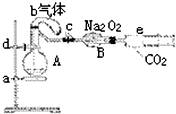 ��ͼ��ʾװ���У�a��ʢ�б����224mL����������ռ���֮һ����10mL 1.2mol/L�������ƿ��b��δ������ʵ�鿪ʼǰ�ڲ�û�����壩װ��0.384gͭ�۵�����c�Ǽн��˵ĵ��ɼУ�d��ʢ�������Ĺ������ƣ�e�dz��ж�����̼��ע����������װ�þ��������Լ���Ѻϸ�
��ͼ��ʾװ���У�a��ʢ�б����224mL����������ռ���֮һ����10mL 1.2mol/L�������ƿ��b��δ������ʵ�鿪ʼǰ�ڲ�û�����壩װ��0.384gͭ�۵�����c�Ǽн��˵ĵ��ɼУ�d��ʢ�������Ĺ������ƣ�e�dz��ж�����̼��ע����������װ�þ��������Լ���Ѻϸ���1���������е�ͭ��С�ĵ�����ƿ�У���ַ�Ӧ����ͭ����ʣ�ࣨ����������岻�ܽ�����Һ�У�����ɹ۲쵽����������Һ����ɫ����ƿ����������ɫ�̶���ɺ�ɫ�������ʹ�
��2�������ͭ�����ᷴӦ�����ʿɲ��ö��ֲ�ͬ�Ĵ�ʩ�����ü��뻯ѧ�Լ����������Լ��п���ʹ�õ��ǣ�����ţ�CD��
A������ˮB����ˮ������C��ʯīD����������������
��3������ƿ��������۲쵽�����������������С��ƿ��������ɫ��dz���йط�Ӧ�Ļ�ѧ����ʽ3NO2+H2O�T2NHNO3+NO��
��4�����ɼ�e����������̼���������ڣ�ʹ��Ӧ��ֽ��У�����ƿ�з�Ӧ��ȫ������һ���ܵĻ�ѧ����ʽ��ʾ��2Cu+4HNO3+O2�T2Cu��NO3��2+2H2O��
��5����ʹ���е�ͭ�۶��ܽ⣬������Ҫ���������̼44.8mL��������Ķ�����̼ȫ����Ӧ����
���� ��1��ͭ��ϡ���ᷴӦ��������ͭ��NO��NO��������е�������Ӧ���ɺ���ɫ��NO2��
��2���ӿ췴Ӧ���ʵ����أ����������Ũ�ȡ������¶ȡ��γ�ԭ��ط�Ӧ�ȣ�
��3����������һ�������Ϳ�����������Ӧ���ɵĶ���������������ˮ����һ�����������
��4����2Na2O2+2CO2�T2Na2CO3+O2��4NO+3O2+2H2O=4HNO3��3Cu+8H++2NO3-=3Cu2++2NO��+4H2O����Ӧ�õ���ƿ�е��ܷ�Ӧ��Ӧ���ܷ���ʽΪ2Cu+4HNO3+O2�T2Cu��NO3��2+2H2O��
��5��Cu�����ᡢ������Ӧ��������ͭ��ˮ������2Na2O2+2CO2�T2Na2CO3+O2��2Cu+4HNO3+O2�T2Cu��NO3��2+2H2O���㣮
��� �⣺��1������ͭ��ϡ����֮��ķ�Ӧ������ȣ���Ӧ��������ͭ��NO��ˮ�����������ӷ�ӦΪ3Cu+8H++2NO3-=3Cu2++2NO��+4H2O����������ͭ��Һ����۲쵽��Һ����ɫ������NO���壬NO��������Ӧ���ɶ�����������ƿ����������ɫ�̶���ɺ�ɫ�������������У���Һ����ɫ����ƿ����������ɫ�̶���ɺ�ɫ�������ʹ�
�ʴ�Ϊ����Һ����ɫ����ƿ����������ɫ�̶���ɺ�ɫ�������ʹ�
��2��A����������ˮ���Ὣ����ϡ�ͷ�Ӧ���ʼ�������A����
B�������ƻ�����ᷴӦ���ɴ��ᣬ����ǿ���Ϊ���ᣬ��Ӧ���ʼ�������B����
C������ʯī��ͭ��ʯī��������Һ���γ�ԭ��ط�Ӧ��Ӱ�췴Ӧ��������C��ȷ��
D������AgNO3��Һ��������������ͭ���û������������γɵ�ԭ����У�����ͭΪ�������ӿ췴Ӧ���ʣ���D��ȷ��
�ʴ�Ϊ��CD��
��3����������һ�������Ϳ�����������Ӧ���ɵĶ���������������ˮ����һ�����������ᣬ����ƿ��������۲쵽�����������������С��ƿ��������ɫ��dz����Ӧ�Ļ�ѧ����ʽΪ��3NO2+H2O�T2NHNO3+NO��
�ʴ�Ϊ�����������С��ƿ��������ɫ��dz 3NO2+H2O�T2NHNO3+NO��
��4����2Na2O2+2CO2�T2Na2CO3+O2��4NO+3O2+2H2O=4HNO3��3Cu+8H++2NO3-=3Cu2++2NO��+4H2O���ܷ�ӦΪ��2Cu+4HNO3+O2�T2Cu��NO3��2+2H2O��
�ʴ�Ϊ��2Cu+4HNO3+O2�T2Cu��NO3��2+2H2O��
��5��n��Cu��=$\frac{0384g}{64g/mol}$=0.006mol����3Cu+8H++2NO3-=3Cu2++2NO��+4H2O��֪��������������CuΪ$\frac{0.01L��1.2mol/L��\frac{1}{4}��3}{2}$=0.0045mol/L��������������CuΪ0.006mol-0.0045mol=0.0015mol����2Na2O2+2CO2�T2Na2CO3+O2��4NO+3O2+2H2O=4HNO3��3Cu+8H++2NO3-=3Cu2++2NO��+4H2O���ܷ�ӦΪ2Cu+4HNO3+O2�T2Cu��NO3��2+2H2O
��֪��2Cu��O2��2CO2��
ͭȫ����Ӧ��Ҫ�������ΪV��O2��=0.003mol��22.4L/mol=0.0672L=67.2mL��a��ʢ�б���µĿ���������ռ���֮һ��224mL����������=224ml��$\frac{1}{5}$=44.8ml�����Բμӷ�Ӧ������Ϊ67.2mL-44.8mL=22.4mL����Ҫ���������̼�������ΪV��CO2��=2��22.4mL=44.8mL��
�ʴ�Ϊ��44.8��
���� ���⿼��ʵ�鷽������ƣ�������ѧ���ķ�������������������ʵ�������Ŀ��飬��ȷʵ�鲽�輰���ʵ������ǽ����Ĺؼ���ע�⣨5������������ԭ��Ӧ���м����ǽ����ѵ㣬��Ŀ�Ѷȴ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | O2��I2��Hg | B�� | CO2��KCl��SiO2 | C�� | Na��K��Rb | D�� | SiC��NaCl��SO2 |
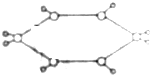 ��֪ij�������ģ����ͼ��ʾ��ͼ�С�-������������˫�����������й�����˵������ȷ���ǣ�������
��֪ij�������ģ����ͼ��ʾ��ͼ�С�-������������˫�����������й�����˵������ȷ���ǣ�������| A�� | ���ڷ����� | B�� | ���³�ѹ��Ϊ���� | ||
| C�� | ������һ�ȴ��������� | D�� | ��ʹ������Ȼ�̼��Һ��ɫ |
| ���� | �۵� | �е� | �ܶ� | �ܽ��� |
| �״� | -97.8�� | 64.8�� | 0.791g•mL-1 | ������ˮ���Ҵ��������� |
| ������ | -126.5�� | 97.4�� | 0.804g•mL-1 | �ܸ�ˮ���״����Ҵ�������Ȼ��� |
| A�� | ��ȡ | B�� | ���� | C�� | ���� | D�� | ���� |
| ���������V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| �����Һ�¶�/�� | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
��1��д��������Ӧ�Ļ�ѧ����ʽNaOH+HCl�TNaCl+H2O���÷�Ӧ���ڷ��ȣ������ȡ����ȡ�����Ӧ��
��2���������������Ϊ8mLʱ����Һ��pH����7��
��3������������l0mL���ϣ���Һ�¶����½���ԭ���ǣ�������������ȴ�������ã���Ӧֹͣ����ɢʧ��
| A�� | ���ۻ������п��Ժ������Ӽ� | |
| B�� | ���ʷ����о������ڻ�ѧ�� | |
| C�� | �����ý���Ԫ�صĻ���������ǹ��ۻ����� | |
| D�� | ���й��ۼ��Ļ�����һ���ǹ��ۻ����� |
| A�� | lmol��Na2CO3���������γɻ����Һ1L����������pH=4ʱ��c��CO32-��+c��HCO3-��+c��H2CO3��=0��lmol/L | |
| B�� | ��״���£�2.24 Lһ�ȼ����к�����ԭ����ĿΪ0.3NA | |
| C�� | �����ʵ�����O2��CO2������ԭ������Ϊ2NA | |
| D�� | 6.8 g���ڵ�KHSO4�к���0.1 NA�������� |
| A�� | CO2��NaCl | B�� | Na2O��Na2O2 | C�� | CaCl2��Na2S | D�� | HCl��NaOH |