题目内容
17.下列说法不正确的是( )| A. | Na2O2可用于呼吸面具中氧气的来源 | |
| B. | NaHCO3的热稳定性大于Na2CO3 | |
| C. | 乙醇可与金属钠反应放出氢气 | |
| D. | 金属钠着火时,可用细沙覆盖灭火 |
分析 A.过氧化钠和二氧化碳反应生成碳酸钠和氧气;
B.碳酸氢钠受热分解生成碳酸钠、二氧化碳和水;
C.乙醇中羟基氢和金属钠反应生成氢气;
D.钠和水、氧气反应,过氧化钠和二氧化碳、水反应生成氧气.
解答 解:A.过氧化钠和人呼出的二氧化碳气体发生反应生成碳酸钠和氧气,可用于呼吸面具中氧气的来源,故A正确;
B.碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,碳酸钠受热不分解,NaHCO3的热稳定性小于Na2CO3 ,故B错误;
C.乙醇和钠发生反应生成乙醇钠和氢气,故C正确;
D.钠和水反应生成氢气,钠燃烧生成过氧化钠,过氧化钠和水、二氧化碳反应生成氧气,氢气能燃烧、氧气能助燃,所以钠着火时不能用水、泡沫灭火器灭火,应该用细沙覆盖灭火,故D正确;
故选B.
点评 本题考查了钠及其化合物性质、主要是碳酸氢钠和碳酸钠化合物稳定性、钠燃烧产物分析、注意知识的积累,题目难度不大.

练习册系列答案
相关题目
7.在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:
根据上表分析:
(1)写出上述反应的化学方程式NaOH+HCl═NaCl+H2O,该反应属于放热(“吸热”或“放热”)反应;
(2)当加入盐酸体积为8mL时,溶液的pH大于7;
(3)当加入盐酸l0mL以上,溶液温度逐渐下降的原因是:过量盐酸起冷却降温作用,反应停止热量散失.
| 加入盐酸积V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 测得溶液温度/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
(1)写出上述反应的化学方程式NaOH+HCl═NaCl+H2O,该反应属于放热(“吸热”或“放热”)反应;
(2)当加入盐酸体积为8mL时,溶液的pH大于7;
(3)当加入盐酸l0mL以上,溶液温度逐渐下降的原因是:过量盐酸起冷却降温作用,反应停止热量散失.
8.中学化学中很多“规律”都有其使用范围,下列有关“规律”推出的结论合理的是( )
| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据共价键的强弱规律,推出HF的沸点强于HCl | |
| D. | 根据无机含氧酸的强弱规律,推出HNO2的酸性强于H3PO3 |
5.常温下,在pH值为4的FeCl3溶液、pH值为10的Na2CO3溶液和pH值为2的盐酸溶液中,水的电离度分别为α1、α2和α3,则它们的关系为( )
| A. | α1=α2>α3 | B. | α1<α2<α3 | C. | α1>α2>α3 | D. | 无法判断 |
12.如图所示,甲装置可直接除去城市废水中的尿素,既能产生净化的水,又能发电.乙装置可用于人工肾脏间接电化学方法除去代谢产物中的尿素的工作原理.

下列关于描述正确的是( )

下列关于描述正确的是( )
| A. | 甲乙装置连接是a接c、b接d | |
| B. | 甲装置工作时H+ 移向负极 | |
| C. | 乙装置阴极室溶液的pH与电解前相比将升高 | |
| D. | a和c电极都发生CO(NH2)2-6e-+H2O═N2↑+CO2↑+6H+ |
2.下列各组化合物中,化学键的类型相同的是( )
| A. | CO2和NaCl | B. | Na2O和Na2O2 | C. | CaCl2和Na2S | D. | HCl和NaOH |
9.请你观察下列几个装置示意图,有关叙述正确的是( )
| A. |  装置中阳极上析出红色固体 | B. | 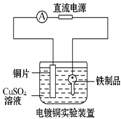 装置中铜片应与电源负极相连 | ||
| C. |  装置中外电路电流方向:b极→a极 | D. |  装中阴极反应:2Cl--2e-═Cl2↑ |
6.下列属于放热反应的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | |
| B. | CaCO3 $\frac{\underline{\;高温\;}}{\;}$ CaO+CO2↑ | |
| C. | C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2 | |
| D. | 2NH4Cl+Ba(OH)2•8H2O═BaCl2+2NH3↑+10H2O |
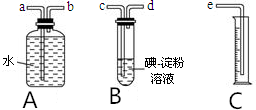 某化学兴趣小组选用如图实验装置,测定某工业尾气(含SO2、N2、O2)中SO2的含量.
某化学兴趣小组选用如图实验装置,测定某工业尾气(含SO2、N2、O2)中SO2的含量.