题目内容
4.水的状态除了气、液和固态外,还有玻璃态.它是由液态水急速冷却到165K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是( )| A. | 水由液态变为玻璃态,体积一定缩小 | |
| B. | 玻璃态水不可能加工为规则的外形 | |
| C. | 玻璃态水中水分子间的作用力与冰中不完全相同 | |
| D. | 玻璃态水是分子晶体 |
分析 A、由玻璃态的水密度与普通液态水的密度相同,质量不变;
B、分子晶体冰是有规则的;
C、氢键与分子间距离有关;
D、根据玻璃态的水无固定形状.
解答 解:A、由玻璃态的水密度与普通液态水的密度相同,质量不变,所以体积不变,故A错误;
B、分子晶体冰是有规则的,所以玻璃态水可能加工为规则的外形,故B错误;
C、氢键与分子间距离有关,玻璃态水氢键基本被破坏,故C正确;
D、玻璃态的水无固定形状,不是分子晶体,故D错误.
故选C.
点评 本题属于信息给予题,解答本题的关键是抓住题干中重要信息:玻璃态的水与普通液态水的密度相同,玻璃态的水无固定形状、不存在晶体结构.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
5.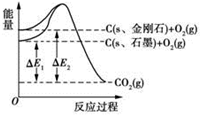 2013年7月23日人民网报道,河南省柘城县科技创新“创”出金刚石产业新天地.1mol石墨在一定条件下完全转化为金刚石,其能量变化如图所示,△E1=393.5kJ,△E2=395.4kJ,下列说法正确的是( )
2013年7月23日人民网报道,河南省柘城县科技创新“创”出金刚石产业新天地.1mol石墨在一定条件下完全转化为金刚石,其能量变化如图所示,△E1=393.5kJ,△E2=395.4kJ,下列说法正确的是( )
 2013年7月23日人民网报道,河南省柘城县科技创新“创”出金刚石产业新天地.1mol石墨在一定条件下完全转化为金刚石,其能量变化如图所示,△E1=393.5kJ,△E2=395.4kJ,下列说法正确的是( )
2013年7月23日人民网报道,河南省柘城县科技创新“创”出金刚石产业新天地.1mol石墨在一定条件下完全转化为金刚石,其能量变化如图所示,△E1=393.5kJ,△E2=395.4kJ,下列说法正确的是( )| A. | 1 mol石墨完全转化为金刚石需吸收1.9 kJ的能量 | |
| B. | 石墨转化为金刚石属于物理变化 | |
| C. | 金刚石的稳定性强于石墨的 | |
| D. | 1 mol金刚石的能量大于1mol CO2的能量 |
15.滴定实验是化学学科中重要的定量实验.
已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称量1.0g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.1000mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如表:
请回答下列问题:
(1)滴定终点时的现象是浅红色变为无色,30S不变色.
(2)所配制的250mL样品液中NaOH的物质的量浓度是0.08 mol•L-1;试样中NaOH的质量分数为80%.
(3)若出现下列情况,测定结果偏高的是ce.
a.滴定前用蒸馏水冲洗锥形瓶
b.在摇动锥形瓶时不慎将瓶内溶液溅出
c.滴定前有气泡,滴定后气泡消失
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗.
已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称量1.0g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.1000mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如表:
| 滴定序号[来源:学科网] | 待测液体积(mL) | 所消耗标准盐酸的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
(1)滴定终点时的现象是浅红色变为无色,30S不变色.
(2)所配制的250mL样品液中NaOH的物质的量浓度是0.08 mol•L-1;试样中NaOH的质量分数为80%.
(3)若出现下列情况,测定结果偏高的是ce.
a.滴定前用蒸馏水冲洗锥形瓶
b.在摇动锥形瓶时不慎将瓶内溶液溅出
c.滴定前有气泡,滴定后气泡消失
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗.
12.下列关于铅蓄电池的说法正确的是( )
| A. | 放电时,正极电极反应是 Pb(s)+SO42-(aq)═PbSO4(s)+2e- | |
| B. | 放电时,电池的负极材料是铅板,负极质量增加 | |
| C. | 充电时,电池中硫酸的浓度始终保持不变 | |
| D. | 充电时,阳极发生的反应是 PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
19.下列关于碱金属、卤族元素的说法正确的是( )
| A. | 碱金属单质的失电子能力随着原子序数的增加而减小 | |
| B. | 从上到下,卤素原子的电子层数依次增多,半径依次减小 | |
| C. | 从F到I,原子核对最外层电子的吸引能力依次减弱,原子的得电子能力依次减弱 | |
| D. | 碱金属单质都是强氧化剂 |
9.下列关于甲、乙、丙、丁四种有机物说法正确的是( )


| A. | 甲、乙、丙、丁中加入NaOH的醇溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,均有沉淀生成 | |
| B. | 甲中加入NaOH的水溶液共热,再滴入AgNO3溶液,可检验该物质中含有的卤素原子 | |
| C. | 乙发生消去反应得到两种烯烃 | |
| D. | 丙与NaOH的水溶液共热,反应后生成的醇能被氧化为醛 |
16.下列离子方程式正确的是( )
| A. | 向盐酸中加入适量氨水:H++OH-═H2O | |
| B. | 铁和稀硝酸反应:Fe+2H+═H2↑+Fe2+ | |
| C. | 在AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 铜与浓HNO3反应:3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑ |
13.下列实验操作中,正确的是( )
| A. | 用量筒量取10.00mL溶液 | B. | 用酒精萃取碘水中的碘 | ||
| C. | 用托盘天平称取2.50g固体 | D. | 用分液漏斗分离乙酸乙酯和水 |

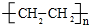

 +NaOH$→_{△}^{CH_{3}CH_{2}OH}$
+NaOH$→_{△}^{CH_{3}CH_{2}OH}$ +NaCl+H2O.
+NaCl+H2O. 任意一种.
任意一种.