题目内容
8.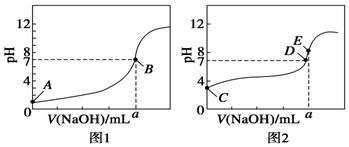 常温下,用0.100 0mol•L-1 NaOH溶液分别滴定20.00mL 0.100 0mol•L-1 HCl溶液和20.00mL 0.100 0mol•L-1 CH3COOH溶液,得到两条滴定曲线,如图所示.
常温下,用0.100 0mol•L-1 NaOH溶液分别滴定20.00mL 0.100 0mol•L-1 HCl溶液和20.00mL 0.100 0mol•L-1 CH3COOH溶液,得到两条滴定曲线,如图所示.(1)①滴定醋酸溶液的曲线是图2(填“图1”或“图2”)
②E点pH>8的原因是(用离子方程式表示):CH3COO-+H2O?CH3COOH+OH-.
(2)实验时,吸取食醋样品10mL于100mL容量瓶中定容.移取定容后的溶液20mL于锥形瓶中,加入2滴酚酞(填指示剂名称),用浓度为c mol•L-1的NaOH标准溶液滴定,平行测定三次,消耗NaOH溶液的平均体积为V mL.则原食醋样品的总酸量=3cV g/100mL.
分析 (1)①醋酸为弱电解质,0.1mol/L的醋酸溶液的pH大于1,据此可以判断图2正确;
②E点时氢氧化钠与醋酸反应生成醋酸钠,醋酸根离子水解,溶液显示碱性;
(2)醋酸与氢氧化钠溶液完全中和后生成醋酸钠溶液,呈碱性,所以应选择在碱性范围内变色的指示剂(酚酞);醋酸与NaOH 溶液反应的定量关系式来解答.
解答 解:(1)①醋酸为弱电解质,醋酸为弱酸,氯化氢为强电解质,0.1mol/L的盐酸溶液的pH=1,而0.1mol/L的醋酸溶液的pH一定大于1,根据图象中氢氧化钠溶液体积为0时溶液的pH可知,滴定醋酸溶液的曲线是图2,
故答案为:图2;
②醋酸钠为强碱弱酸盐,醋酸根离子水解,溶液呈碱性,水解的离子方程式为:CH3COO-+H2O?CH3COOH+OH-,
故答案为:CH3COO-+H2O?CH3COOH+OH-;
(2)醋酸与氢氧化钠溶液完全中和后生成醋酸钠溶液,溶液呈碱性,所以应选择在碱性范围内变色的指示剂酚酞,设10mL市售白醋样品含有 CH3COOOH xg,则
CH3COOOH~NaOH
60 40
xg×0.2 cmol•L-1×V×10-3L×40g/mol
解得:x=0.3cV
则原食醋样品的总酸量=0.3cV×10=3cVg/100mL;
故答案为:3cV.
点评 本题综合考查物质的含量测定、酸碱混合的定性判断和计算以及弱电解质的电离和盐类的水解等知识,题目难度中等,但信息量较大,答题时注意审题.

练习册系列答案
相关题目
18.在同温同压下,有同质量的气体甲与乙,已知此时甲的体积小于乙的体积.则下列说法正确的是( )
| A. | 甲的分子数比乙的分子数多 | |
| B. | 甲的摩尔体积比乙的摩尔体积小 | |
| C. | 甲的相对分子质量比乙的相对分子质量大 | |
| D. | 甲的物质的量比乙的物质的量少 |
19.NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 标准状况下,44.8 LH2O含有的水分子数为2NA | |
| B. | 88gC02含有的C02分子数为2NA | |
| C. | 46gNO2气体含有的氧原子数为NA | |
| D. | 1mol的任何气体中都含有NA个原子 |
16.常温下,在溶液中可以发生反应:X+2Y3+═2Y2++X2+,对下列叙述的判断正确的是( )
①X被氧化 ②X是氧化剂 ③X具有还原性 ④Y2+是氧化产物 ⑤Y2+具有还原性 ⑥Y3+的氧化性比X2+的氧化性强.
①X被氧化 ②X是氧化剂 ③X具有还原性 ④Y2+是氧化产物 ⑤Y2+具有还原性 ⑥Y3+的氧化性比X2+的氧化性强.
| A. | ②③④⑥ | B. | ①③④⑤ | C. | ①③⑤⑥ | D. | ①②⑤⑥ |
3.下列溶液中氯离子浓度与50mL 1mol/L氯化铝溶液中氯离子浓度相等的是( )
| A. | 150mL1mol/L的氯化钠溶液 | B. | 75mL2mol/L的氯化铵溶液 | ||
| C. | 150mL3mol/L的氯化钾溶液 | D. | 75mL1mol/L的氯化亚铁溶液 |
13.下列电子转移的表示正确的是( )
| A. |  ↑+2H2O ↑+2H2O | B. |  (浓)═Cu(NO3)2+2NO2↑+2H2O (浓)═Cu(NO3)2+2NO2↑+2H2O | ||
| C. |  | D. |  ═KCl+3Cl2↑+3H2O ═KCl+3Cl2↑+3H2O |
20.某元素原子的核外M层电子数是4,该原子核内的质子数是( )
| A. | 14 | B. | 15 | C. | 16 | D. | 17 |
17.实验室中需要配制2mol/L的NaCl溶液480mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是( )
| A. | 480mL 56.2g | B. | 500mL 58.5g | ||
| C. | 1000mL 58.5g | D. | 任意规格 56.2g |
11.下列所得溶液的物质的量浓度为0.1mol•L-1的是( )
| A. | 将0.1mol氨充分溶解在1L水中 | |
| B. | 将10g质量分数为98%的硫酸与990g水混合 | |
| C. | 将10mL•1mol•L-1的盐酸与90mL水充分混合 | |
| D. | 将25.0g胆矾(CuSO4•5H2O)溶于水配成1L溶液 |