题目内容
 U、V、W、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数变化如图所示.已知U的一种核素的质量数为14,中子数为7;V的离子与NH
U、V、W、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数变化如图所示.已知U的一种核素的质量数为14,中子数为7;V的离子与NH+ 4 |
(1)X在周期表中的位置是
(2)W的阳离子结构示意图:
(3)X、Y、Z的气态氢氧化物中最稳定的是(写化学式)
(4)化合物V3U电子式:
(5)0.1mol/L的V2Y溶液中的离子浓度等量关系式:
(6)用铁电极电解滴有一层煤油的VZ溶液,总反应的化学方程式是
考点:位置结构性质的相互关系应用
专题:
分析:U、V、W、X、Y、Z是六种常见的短周期元素,U的一种核素的质量数为14,中子数为7,质子数为14-7=7,故U为氮元素;V的离子与NH4+具有相同的质子、电子数目,V的质子数为11,故V为Na元素,W的周期数与主族序数相等,且半径小于钠,故W为铝元素;由图可知,X、Y、Z的原子序数依次增大,X的最高正化合价和负化合价代数和为0,故X为ⅣA族元素,都处于第三周期,故X为硅元素,U与Y的氧化物均能导致酸雨的形成,故Y为硫元素;Z得电子能力在同周期主族元素中最强,故Z为Cl元素,据此解答各小题即可.
解答:
解:U、V、W、X、Y、Z是六种常见的短周期元素,U的一种核素的质量数为14,中子数为7,质子数为14-7=7,故U为氮元素;V的离子与NH4+具有相同的质子、电子数目,V的质子数为11,故V为Na元素,W的周期数与主族序数相等,且半径小于钠,故W为铝元素;由图可知,X、Y、Z的原子序数依次增大,X的最高正化合价和负化合价代数和为0,故X为ⅣA族元素,都处于第三周期,故X为硅元素,U与Y的氧化物均能导致酸雨的形成,故Y为硫元素;Z得电子能力在同周期主族元素中最强,故Z为Cl元素,依据分析可知:U为氮、V为钠、W为铝、X为硅、Y为硫、Z为氯,
(1)X为Si,Si处于第三周期第Ⅳ族,故答案为:第三周期第ⅣA族;
(2)W为铝,Al离子结构示意图为: ,铝离子在水中发生水解生成氢氧化铝胶体,离子反应方程式为:Al3++3H2O?Al(OH)3+3H+,
,铝离子在水中发生水解生成氢氧化铝胶体,离子反应方程式为:Al3++3H2O?Al(OH)3+3H+,
故答案为: ;Al3++3H2O?Al(OH)3+3H+;
;Al3++3H2O?Al(OH)3+3H+;
(3)元素的非金属性越强,其气态氢化物的稳定性越强,最高价氧化物的水化物的酸性越强,由于Si、S、Cl的非金属性强弱顺序为:Cl>S>Si,故它们气态氢氧化物中最稳定的是HCl,酸性最弱的是硅酸:3H2SiO3,氢原子只具有一个电子,容易形成共价化合物,具有共价键,故答案为:HCl;H2SiO3;共价键;(4)化合物V3U为Na3N,钠元素和氮元素分别是活泼的金属和活泼的非金属,所以二者形成的化学键是离子键,Na3N的电子式为: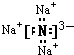 ,氮化钠和水发生了复分解反应,反应的方程式是:Na3N+3H2O=3NaOH+NH3↑,故答案为:
,氮化钠和水发生了复分解反应,反应的方程式是:Na3N+3H2O=3NaOH+NH3↑,故答案为: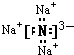 ;Na3N+3H2O=3NaOH+NH3↑;
;Na3N+3H2O=3NaOH+NH3↑;
(5)0.1mol/L的Na2S溶液中,S2-离子水解生成HS-和H2S,依据S元素守恒知:溶液中的离子浓度等量关系式为:c(S2-)+c(HS-)+c(H2S)=0.1mol/L,故答案为:c(S2-)+c(HS-)+c(H2S);
(6)用铁电极电解滴有一层煤油的NaCl溶液,阳极铁放电,阴极氢离子放电,导致溶液呈碱性,碱性溶液中亚铁离子生成氢氧化亚铁,总反应的化学方程式是:Fe+2H2O
H2↑+Fe(OH)2↓,故答案为:Fe+2H2O
H2↑+Fe(OH)2↓.
(1)X为Si,Si处于第三周期第Ⅳ族,故答案为:第三周期第ⅣA族;
(2)W为铝,Al离子结构示意图为:
 ,铝离子在水中发生水解生成氢氧化铝胶体,离子反应方程式为:Al3++3H2O?Al(OH)3+3H+,
,铝离子在水中发生水解生成氢氧化铝胶体,离子反应方程式为:Al3++3H2O?Al(OH)3+3H+,故答案为:
 ;Al3++3H2O?Al(OH)3+3H+;
;Al3++3H2O?Al(OH)3+3H+;(3)元素的非金属性越强,其气态氢化物的稳定性越强,最高价氧化物的水化物的酸性越强,由于Si、S、Cl的非金属性强弱顺序为:Cl>S>Si,故它们气态氢氧化物中最稳定的是HCl,酸性最弱的是硅酸:3H2SiO3,氢原子只具有一个电子,容易形成共价化合物,具有共价键,故答案为:HCl;H2SiO3;共价键;(4)化合物V3U为Na3N,钠元素和氮元素分别是活泼的金属和活泼的非金属,所以二者形成的化学键是离子键,Na3N的电子式为:
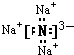 ,氮化钠和水发生了复分解反应,反应的方程式是:Na3N+3H2O=3NaOH+NH3↑,故答案为:
,氮化钠和水发生了复分解反应,反应的方程式是:Na3N+3H2O=3NaOH+NH3↑,故答案为: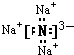 ;Na3N+3H2O=3NaOH+NH3↑;
;Na3N+3H2O=3NaOH+NH3↑;(5)0.1mol/L的Na2S溶液中,S2-离子水解生成HS-和H2S,依据S元素守恒知:溶液中的离子浓度等量关系式为:c(S2-)+c(HS-)+c(H2S)=0.1mol/L,故答案为:c(S2-)+c(HS-)+c(H2S);
(6)用铁电极电解滴有一层煤油的NaCl溶液,阳极铁放电,阴极氢离子放电,导致溶液呈碱性,碱性溶液中亚铁离子生成氢氧化亚铁,总反应的化学方程式是:Fe+2H2O
| ||
| ||
点评:本题主要考查的是元素的推断,以此为载体涉及知识点:电子式书写、水解反应方程式、物料守恒、电解池原理等,综合性较强,难度较大.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、在碳酸氢钠溶液中加入过量的氢氧化钙溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| B、向明矾溶液中加入少量的Ba(OH)2溶液:Al3++3OH-+Ba2++SO42-=BaSO4↓+Al(OH)3↓ |
| C、向Fe2(SO4)3溶液中加入过量的Na2S:2Fe3++S2-=2Fe2++S↓ |
| D、向含有1molFeBr2溶液中通入标准状况下22.4L的Cl2:2Br-+Cl2=Br2+2Cl- |
火星表面还有火星表面还有黄钾铁矾,其组成的化学式为KFe3(SO4)2(OH)6,易溶于稀硫酸,下列说法不正确的是( )
| A、黄钾铁矾中铁元素显+3价 |
| B、黄钾铁矾属于碱 |
| C、黄钾铁矾溶于硫酸后,滴加KSCN溶液,溶液变红 |
| D、黄钾铁矾晶体在酒精灯火焰上灼烧,透过蓝色的钴玻璃可观察到紫色火焰 |
在解释下列物质性质的变化规律与物质结构间的因果关系时,与化学键的强弱无关的变化规律是( )
| A、HF、HCl、HBr、HI的热稳定依次减弱 |
| B、金刚石的硬度大于硅,其熔、沸点也高于硅 |
| C、NaF、NaCl、NaBr、NaI的熔点依次减小 |
| D、F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
 卤代烃里的卤原子易与活泼金属阳离子结合,发生下列反应:
卤代烃里的卤原子易与活泼金属阳离子结合,发生下列反应: 如图中,纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,试按题意将相应图示的字母填入下表.
如图中,纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,试按题意将相应图示的字母填入下表.