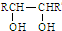题目内容
将a g纯Cu片投入足量的一定浓度的硝酸溶液中,反应中消耗的HNO3为b g,若a:b=8:21,则反应中起酸性作用的HNO3的质量为 .
考点:化学方程式的有关计算
专题:计算题
分析:根据a:b=8:21,则物质的量之比为
:
=3:8,刚好符合铜和稀硝酸反应的物质的量之比,根据起酸性作用的HNO3生成硝酸铜,则起酸性作用的硝酸的物质的量n(HNO3)=2n[Cu(NO3)2]=
×2,所以起酸性作用的HNO3的质量
×2×63=
g.
| 8 |
| 64 |
| 21 |
| 63 |
| a |
| 64 |
| a |
| 64 |
| 63a |
| 32 |
解答:
解:根据a:b=8:21,则物质的量之比为
:
=3:8,刚好符合铜和稀硝酸反应的物质的量之比,根据起酸性作用的HNO3生成硝酸铜,则起酸性作用的硝酸的物质的量n(HNO3)=2n[Cu(NO3)2]=
×2,所以起酸性作用的HNO3的质量
×2×63=
g,故答案为:
g.
| 8 |
| 64 |
| 21 |
| 63 |
| a |
| 64 |
| a |
| 64 |
| 63a |
| 32 |
| 63a |
| 32 |
点评:本题考查了物质的量的有关计算,题目难度不大,注意硝酸的性质,起酸性作用的HNO3生成硝酸铜.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案
相关题目
在解释下列物质性质的变化规律与物质结构间的因果关系时,与化学键的强弱无关的变化规律是( )
| A、HF、HCl、HBr、HI的热稳定依次减弱 |
| B、金刚石的硬度大于硅,其熔、沸点也高于硅 |
| C、NaF、NaCl、NaBr、NaI的熔点依次减小 |
| D、F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
下列化学用语或模型正确的是( )
| A、乙烯的结构简式:CH2CH2 |
B、甲烷分子的比例模型: |
C、羟基的电子式: |
| D、葡萄糖的最简式:C6H12O6 |
PCl3和PCl5都是重要的化工原料.将PCl3(g) 和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,并于10 min时达到平衡:PCl3(g)+Cl3(g)?PCl3(g).有关数据如下:

下列判断不正确的是( )

下列判断不正确的是( )
| A、10 min内,v(Cl2)=0.04 mol/(L?min) |
| B、当容器中Cl2为1.2 mol时,反应达到平衡 |
| C、升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3的转化率变大 |
| D、平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
下列有关实验说法不正确的是( )
| A、在用简易量热计测定反应热时,可使用碎泡沫起隔热保温作用、环形玻璃搅拌棒进行搅拌使其充分反应、读取反应中温度计的最高温度、取2-3 次的实验平均值,以达到良好的实验效果 |
| B、纸上层析属于色谱分析法,其原理仅和“毛细现象”相关 |
| C、向1mL0.5mol?L-1AlCl3溶液中滴加2mL饱和NaF溶液,再滴加1mL 3.0mol?L-1 NH3?H2O溶液,无沉淀生成,说明Al3+更易与F-结合成AlF63-- |
| D、为了使过饱和溶液中析出晶体,可用玻璃棒摩擦与溶液接触处的试管壁 |
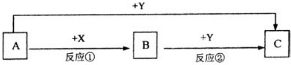 A、B、C三种物质的转化关系如图所示(部分产物已略去)
A、B、C三种物质的转化关系如图所示(部分产物已略去)