题目内容
13.取500.0mL Na2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到6.27g白色沉淀,用过量稀硝酸处理后沉淀量减少到2.33g,并有气体放出.试计算:(1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度分别为0.04mol/L,0.02mol/L;
(2)产生的气体在标准状况下的体积0.448L.
分析 发生反应有Na2CO3+BaCl2=BaCO3↓+2NaCl,Na2SO4+BaCl2=BaSO4↓+2NaCl,BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O,6.27g白色沉淀是碳酸钡、硫酸钡的质量之和,用过量稀硝酸处理后沉淀量减少到2.33g,为硫酸钡的质量,故碳酸钡的质量为6.27g-2.33g=3.94g,根据n=$\frac{m}{M}$计算碳酸钡、硫酸钡的物质的量;
(1)根据守恒计算n(Na2CO3)、n(Na2SO4),再根据c=$\frac{n}{V}$计算;
(2)根据碳原子守恒可知n(CO2)=n(Na2CO3),根据V=nVm计算二氧化碳的体积.
解答 解:发生反应有Na2CO3+BaCl2=BaCO3↓+2NaCl,Na2SO4+BaCl2=BaSO4↓+2NaCl,BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O,6.27g白色沉淀是碳酸钡、硫酸钡的质量之和,用过量稀硝酸处理后沉淀量减少到2.33g,为硫酸钡的质量,故n(BaSO4)=$\frac{2.33g}{233g/mol}$=0.01mol,故碳酸钡的质量为:6.27g-2.33g=3.94g,故n(BaCO3)=$\frac{3.94g}{197g/mol}$=0.02mol,
(1)根据守恒n(Na2CO3)=n(BaCO3)=0.02mol,故c(K2CO3)=$\frac{0.02mol}{0.5L}$=0.04mol/L;
n(Na2CO3)=n(BaSO4)=0.01mol,故c(Na2SO4)=$\frac{0.01mol}{0.5L}$=0.02mol/L,
故答案为:0.04mol/L;0.02mol/L;
(2)根据碳原子守恒可知n(CO2)=n((BaCO3)=0.02mol,故二氧化碳的体积为:v(CO2)=0.02mol×22.4L/mol=0.448L,
故答案为:0.448L.
点评 本题考查混合物的有关计算,题目难度中等,明确反应的实质是解题关键,注意碳酸钡和硫酸钡的性质及守恒思想的利用,试题培养了学生的分析能力及化学计算能力.

| A. | 天然气 | B. | 油田气 | C. | 水煤气 | D. | 沼气 |
| A. | Cu(OH)2与H2SO4 | B. | Ba(OH)2与H2SO4 | C. | Ba(OH)2与HCl | D. | KHSO4与Ba(OH)2 |
| A. | 0.025 mol/L | B. | 0.30mol/L | C. | 0.36mol/L | D. | 0.45mol/L |
| A. | 冰毒、黄连素 | B. | 海洛因、麻黄碱 | C. | 大麻、摇头丸 | D. | 黄曲霉素、尼古丁 |
| A. | 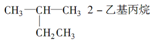 | B. | CH3CH2CH2CH2OH 1-丁醇 | ||
| C. | 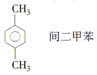 | D. |  |
 如图所示①②③④分别是几种常见漏斗的上部,A、B、C、D是实际操作应用时,各漏斗的下部插入容器中的示意图.请指出A、B、C、D分别与①②③④相匹配的可能组合:A与③; B与②④(或①②④);C与①; D与④.
如图所示①②③④分别是几种常见漏斗的上部,A、B、C、D是实际操作应用时,各漏斗的下部插入容器中的示意图.请指出A、B、C、D分别与①②③④相匹配的可能组合:A与③; B与②④(或①②④);C与①; D与④.