题目内容
12.在下列给定条件的溶液中,一定能大量共存的离子组是( )| A. | 无色溶液:Al3+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、Fe3+、NO3- | |
| C. | FeCl3溶液:K+、Na+、NO3-、SCN- | |
| D. | 由水电离出的C(H+)=10-13mol/L的溶液:Na+、K+、SiO32-、NO3- |
分析 A.铝离子与碳酸氢根离子发生双水解反应;
B.能使pH试纸呈红色的溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应;
C.铁离子与硫氰根离子反应;
D.该溶液呈酸性或碱性,硅酸根离子与氢离子反应.
解答 解:A.Al3+、HCO3-之间发生双水解反应,在溶液中不能大量共存,故A错误;
B.能使pH试纸呈红色的溶液呈酸性,溶液中存在大量氢离子,Na+、NH4+、Fe3+、NO3-之间不反应,都不与氢离子反应,在溶液中能够大量共存,故B正确;
C.FeCl3与SCN-之间发生络合反应生成硫氰化铁,在溶液中不能大量共存,故C错误;
D.由水电离出的C(H+)=10-13mol/L的溶液中存在大量氢离子或氢氧根离子,SiO32-与氢离子反应,在酸性溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
3.下列气体主要成分不是甲烷的是( )
| A. | 天然气 | B. | 油田气 | C. | 水煤气 | D. | 沼气 |
20.25°C时,某化学实验小组同学向用大理石和稀盐酸制备CO2后的残留液中滴加碳酸钠溶液,在溶液中插入pH传感器,测得pH变化曲线如图所示.下列说法不正确的是( )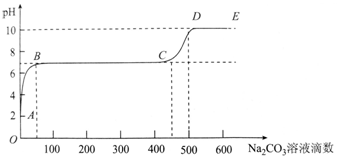

| A. | 开始时溶液pH=2是因为残留液中还有盐酸剩余 | |
| B. | BC段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加 | |
| C. | 滴入500滴碳酸钠溶液后溶液中c(OH-)>c(H+) | |
| D. | AB发生的反应为:Ca2++CO32-═CaCO3↓ |
7.现有三组实验:
①分离花生油和水
②分离乙二醇和丙三醇.已知乙二醇(C2H6O2)是无色液体,易溶于水和乙醇,沸点198℃.丙三醇(C3H8O3)是无色液体,易溶于水和乙醇,沸点290℃
③用食用酒精浸泡中草药提取其中的有效成份.
正确方法依次是( )
①分离花生油和水
②分离乙二醇和丙三醇.已知乙二醇(C2H6O2)是无色液体,易溶于水和乙醇,沸点198℃.丙三醇(C3H8O3)是无色液体,易溶于水和乙醇,沸点290℃
③用食用酒精浸泡中草药提取其中的有效成份.
正确方法依次是( )
| A. | 分液、蒸馏、分液 | B. | 分液、蒸馏、萃取 | C. | 蒸馏、蒸馏、萃取 | D. | 蒸馏、分液、萃取 |
17.下列金属氧化物中,一般不用铝热反应来进行难熔金属冶炼的是( )
| A. | MnO2 | B. | Fe3O4 | C. | MgO | D. | Cr2O3 |
1.H++OH-=H2O表示下列哪组离子反应( )
| A. | Cu(OH)2与H2SO4 | B. | Ba(OH)2与H2SO4 | C. | Ba(OH)2与HCl | D. | KHSO4与Ba(OH)2 |
2.下列有机物命名正确的是( )
| A. |  | B. | CH3CH2CH2CH2OH 1-丁醇 | ||
| C. |  | D. |  |