题目内容
11.合成氨原料气H2可通过CO和水蒸气在一定条件下反应制得.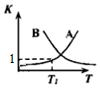
(1)已知CO和H2的燃烧热分别是283.0kJ/mol、285.8kJ/mol,lg液态水变成水蒸气时要吸收2.44kJ的热量;则该反应的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.12kJ/mol;.
(2)该反应随温度升高正、逆反应平衡常数的变化曲线如图所示,表示K正的曲线为B(选填“A”或“B”),理由是正反应为放热反应,升高温度,平衡向逆向移动,K值减小.
(3)T1℃时,向容积固定为5L的容器中充入2mol水蒸气和3molCO,发生上述反应达平衡,则平衡时水蒸气的转化率是60%(填字母)
(4)保持温度为T1℃,改变水蒸气和CO的初始物质的量之比,充入恒容容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填字母)
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a molH2
d.混合气中 n(CO):n(H2O):n(CO2):n(H2)=9:4:6:6
(5)某工业合成氨的原料气组成为:H240%、N220%、CO30%、CO210% (均为体积分数).向上述原料气中加入水蒸气,以除去其中的CO.己知不同温度下的反应物投料比[$\frac{n({H}_{2}0)}{n(C0)}$],平衡时混合气体中CO的体积分数如表所示:
| CO体积分数% 投料比 | 温度/℃ | ||||
| 200 | T2 | T3 | T4 | ||
| $\frac{n({H}_{2}0)}{n(C0)}$ | 1 | 1.70 | 2.73 | 6.00 | 7.85 |
| 3 | 0.21 | 0.30 | 0.84 | 1.52 | |
| 5 | 0.02 | 0.06 | 0.43 | 0.80 | |
②维持温度不变,若要使CO的转化率升高,可以改变的条件是加水/增大H2O和CO投料比/减小生成物浓度(分离出产物).
③温度为T3℃、$\frac{n({H}_{2}0)}{n(C0)}$=1时,变换后的平衡混合气体中H2的体积分数是47.8%.
分析 (1)根据CO和H2的燃烧热分别是283.0kJ/mol、285.8kJ/mol,lg液态水变成水蒸气时要吸收2.44kJ的热量;可得①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1,
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8•mol -1,
③H2O(l)═H2O(g)△H=+44kJ•mol-1,
根据盖斯定律①-②-③可得CO(g)+H2O(g)=CO2 (g)+H2 (g),计算可得;
(2)正反应为放热反应,升高温度,平衡向逆向移动,K值减小;
(3)设平衡时水蒸气的转化率为a,列三段式,根据图可知T1℃时,K=1,代入K可得;
(4)根据化学平衡时,正逆反应速率相等,各组分浓度保持不变判断;
(5)①该反应是放热反应,根据温度对化学平衡的影响判断;
②维持温度不变,要使CO的转化率升高,可用加水/增大H2O和CO投料比/减小生成物浓度(分离出产物);
③该反应是气体体积不变的反应,设反应前气体总体积为VL,计算出反应前CO、二氧化碳的体积;$\frac{n({H}_{2}O)}{n(CO)}$=1,则加入水蒸气的体积与CO的体积相等,从而得出反应达到平衡时总体积;然后根据反应方程式、达到平衡时CO的体积分数计算出反应生成氢气的体积,再计算出氢气的体积分数.
解答 解:(1)根据CO和H2的燃烧热分别是283.0kJ/mol、285.8kJ/mol,lg液态水变成水蒸气时要吸收2.44kJ的热量;可得①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1,
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8•mol -1,
③H2O(l)═H2O(g)△H=+44kJ•mol-1,
根据盖斯定律①-②-③可得CO(g)+H2O(g)=CO2 (g)+H2 (g)△H=-41.12 kJ/mol;
故答案为:CO(g)+H2O(g)=CO2 (g)+H2 (g)△H=-41.12 kJ/mol;
(2)正反应为放热反应,升高温度,平衡向逆向移动,K值减小,曲线为B;
故答案为:B;正反应为放热反应,升高温度,平衡向逆向移动,K值减小;
(3)容积固定为5L的容器,设平衡时水蒸气的转化率为a,列三段式:
CO(g)+H2O(g)=CO2 (g)+H2 (g)
起始(mol/L):0.6 0.4 0 0
转化(mol/L):0.4a 0.4a 0.4a 0.4a
平衡(mol/L):0.6-0.4a 0.4-0.4a 0.4a 0.4a
根据图可知T1℃时,K=$\frac{0.4a×0.4a}{(0.6-0.4a)×(0.4-0.4a)}$=1,解得,a=0.6=60%;
故答案为:60%;
(4)反应 CO(g)+H2O(g)=CO2 (g)+H2 (g):
a.该反应是气体体积不变,任何时刻容器内压强都一样,故a错误;
b.混合气体总质量不变,恒容容器体积不变,根据$ρ=\frac{m}{V}$混合气体的密度不改变,故b错误;
c.单位时间内生成a mol CO2说明生成了a mol的H2,同时消耗a molH2,说明正逆反应速率相等,故c正确;
d.混合气中 n(CO):n(H2O):n(CO2):n(H2)=9:4:6:6,设容器体积为V,则此时Qc=$\frac{(6÷V)×(6÷V)}{(9÷V)×(4÷V)}$=1=K,反应在平衡状态,故d正确;
故答案为:c d;
(5)①该反应正向为放热反应,在其他条件不变的条件下,升高温度,平衡逆向移动,CO的体积分数会增大,所以T2<T3<T4;
故答案为;T2<T3<T4;该反应正向为放热反应,在其他条件不变的条件下,升高温度,平衡逆向移动,CO的体积分数会增大,所以T2<T3<T4;
②维持温度不变,要使CO的转化率升高,可用加水/增大H2O和CO投料比/减小生成物浓度(分离出产物);
故答案为:加水/增大H2O和CO投料比/减小生成物浓度(分离出产物);
③反应CO(g)+H2O(g)?CO2(g)+H2(g)中,反应恰好气体的体积不变,则反应过程中气体的总体积不变,设反应前气体总体积为V,则CO的体积为30%VL=0.3VL,二氧化碳的体积为:10V%=0.1V,
由于$\frac{n({H}_{2}O)}{n(CO)}$=1,则加入的水蒸气的体积为30%V,反应达到平衡时气体总体积为:V+0.3V=1.3V,
温度为300℃达到平衡时CO的体积分数为6%,则反应消耗的CO=生成的H2的体积=0.3V-1.3V×6%=0.222V,达到平衡时H2的体积分数为$\frac{0.222V+0.4V}{1.3V}$×100%=47.8%;
故答案为:47.8%.
点评 本题考查了化学平衡、化学平衡常数的计算、影响化学反应速率、化学平衡的因素等知识,题目难度较大,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

 阅读快车系列答案
阅读快车系列答案| A. | 1mol任何气体的体积都约是22.4L | |
| B. | lmolH2和O2的混合气体,在标准状况下的体积约为22.4L | |
| C. | lmol H2气态物质,当体积为22.4L时,该气体一定处于标准状况 | |
| D. | 标准状况下,2molH2O体积约为44.8L |
(1)煤制天然气时会发生多个反应,生产过程中有多种途径生成CH4.
已知:C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
CO(g)+3H2(g)?CH4(g)+H2O(g)△H=-203kJ•mol-1
写出CO与H2O(g)反应生成H2和CO2的热化学方程式CO(g)+H2O(g)=H2(g)+CO2(g),△H=-41kJ/mol.
(2)天然气中含有H2S杂质,某科研小组用氨水吸收得到NH4HS溶液,
已知T℃,k(NH3•H2O)=1.74×10-5,k1(H2S)=1.07×10-7,k2(H2S)=1.74×10-13,NH4HS溶液中所含粒子浓度大小关系正确的是ac.
a.[NH4+]>[HS-]>[OH-]>[H+]b.[HS-]>[NH4+]>[S2-]>[H+]
c.[NH4+]>[HS-]>[H2S]>[H+]d.[HS-]>[S2-]>[H+]>[OH-]
(3)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为:CH4(g)+H2O(g)═CO(g)+3H2(g).
①该反应的逆反应速率表达式为:v=kc(CO)c3(H2),k为速率常数,在某温度下,测得实验数据如表:
| CO浓度(mol•L-1) | H2浓度(mol•L-1) | 逆反应速率(mol•L-1•min-1) |
| 0.1 | c1 | 9.6 |
| c2 | c1 | 19.2 |
| c2 | 0.3 | 64.8 |
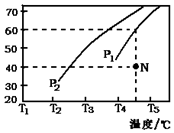
②在体积为2L的密闭容器中通入物质的量均为2mol的CH4和水蒸气,在一定条件下发生反应,测得H2的体积分数与温度及压强的关系如图2所示,则压强P1大于P2(填“大于”或“小于”);温度T3小于T4(填“大于”或“小于”);
③压强为P1时,在N点:v正大于v逆(填“大于”、“小于”或“等于”). 求N点对应温度下该反应的平衡常数K=48.
 臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)+O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如下表及图所示,下列说法正确的是( )
臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)+O2(g)△H.不同温度下,在三个容器中发生上述反应,相关信息如下表及图所示,下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积/L | 1 | 1 | 2 |
| 反应物起始量 | 2mol NO2,1mol O3 | 2mol NO2,1mol O3 | 2mol NO2,1mol O3 |
| 温度 | T1 | T2 | T2 |
| A. | 0~10min内甲容器中反应的平均速率:v(NO2)=0.02mol•L-1•min-1 | |
| B. | T1<T2,△H>0 | |
| C. | 平衡时N2O5浓度:c乙(N2O5)>c丙(N2O5) | |
| D. | T1℃时,若起始时间向容器甲中充入2molNO2、1molO3、2molN2O5和2mol O2,则脱硝反应达到平衡前,v(正)<c(逆) |
| 共价键 | H-H | N≡N | N-H |
| 键能(kJ•mol-1) | 436 | 945 | 391 |
②若将1mol N2和3mol H2放入一密闭容器中在催化剂存在下进行反应,理论上放出或吸收的热量为Q1,而在实际生产中,放出或吸收的热量为Q2,Q1与Q2比较,正确的是A.
A.Q1>Q2 B.Q1<Q2 C.Q1=Q2.
| A. | 天然气 | B. | 油田气 | C. | 水煤气 | D. | 沼气 |
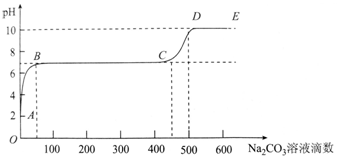
| A. | 开始时溶液pH=2是因为残留液中还有盐酸剩余 | |
| B. | BC段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加 | |
| C. | 滴入500滴碳酸钠溶液后溶液中c(OH-)>c(H+) | |
| D. | AB发生的反应为:Ca2++CO32-═CaCO3↓ |
| A. | Cu(OH)2与H2SO4 | B. | Ba(OH)2与H2SO4 | C. | Ba(OH)2与HCl | D. | KHSO4与Ba(OH)2 |