题目内容
4.室温时,向10mL的醋酸稀溶液中逐滴滴入NaOH稀溶液至过量,有关叙述正确的是( )| A. | 实验过程中水的电离程度的变化是先增大后减小 | |
| B. | 当溶液呈中性时,反应恰好完全 | |
| C. | 当反应恰好完全时,消耗NaOH溶液10mL | |
| D. | 当溶液呈碱性时,其中离子浓度由大到小的顺序可能为c(Na+)>c(OH-)>c(Ac-)>c(H+) |
分析 A.酸或碱抑制水电离,且酸或碱浓度越大其抑制水电离程度越大,含有弱离子的盐促进水电离;
B.醋酸钠是强碱弱酸盐,其水溶液呈碱性,要使混合溶液呈中性,醋酸应该稍微过量;
C.二者恰好完全反应时,二者的物质的量相等;
D.当溶液呈碱性时,溶液中溶质可能是醋酸钠和NaOH,可能是醋酸钠,也可能是醋酸钠和极少量的醋酸.
解答 解:A.酸或碱抑制水电离,且酸或碱浓度越大其抑制水电离程度越大,含有弱离子的盐促进水电离,所以实验过程中醋酸的物质的量逐渐减少、醋酸钠的物质的量逐渐增大、当二者恰好完全后,再加入NaOH,NaOH的物质的量逐渐增多,所以水的电离程度先增大后减小,故A正确;
B.醋酸钠是强碱弱酸盐,其水溶液呈碱性,要使混合溶液呈中性,醋酸应该稍微过量,所以当溶液呈中性时,二者不是恰好完全反应,故B错误;
C.二者恰好完全反应时,二者的物质的量相等,因为两种溶液的浓度相对大小未知,无法确定碱溶液体积,故C错误;
D.当溶液呈碱性时,溶液中溶质可能是醋酸钠和NaOH,可能是醋酸钠,也可能是醋酸钠和极少量的醋酸,溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒得c(Na+)>c(Ac-),当NaOH的物质的量远远大于醋酸钠物质的量时,则存在c(OH-)>c(Ac-),所以溶液呈碱性时可能存在c(Na+)>c(OH-)>c(Ac-)>c(H+),故D正确;
故选AD.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析判断能力,明确电解质的性质、混合溶液中溶质成分及其性质、溶液酸碱性是解本题关键,注意离子浓度大小比较方法及离子浓度大小与溶质浓度的关系,易错选项是D.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
12.下列关于常见物质的工业冶炼说法正确的是( )
| A. | 工业制金属钠:电解饱和食盐水 | |
| B. | 工业炼铁:需要用到的原料有铁矿石、焦炭、空气和生石灰 | |
| C. | 冶炼镁:将六水合氯化镁晶体在一定条件下加热得到无水氯化镁,电解熔融氯化镁,可以得到金属镁 | |
| D. | 硫酸工业:在氧气充足的情况下,从接触室进入吸收塔的气体中不可能含有SO2 |
19.按如图实验,反应后可能出现的现象是( )
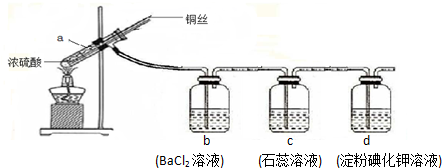

| A. | a装置中有白色固体 | B. | b装置中产生白色沉淀 | ||
| C. | c装置中溶液先变红后褪色 | D. | d装置中溶液变蓝色 |
13.短周期主族元素X、Y、Z、W原子序数依次增大,X的原子半径是所有元素中最小的,Y原子最外层有4个电子,Z是空气中含量最多的元素,W是至今发现的非金属性最强的元素.下列叙述正确的是( )
| A. | 原子半径由大到小的顺序:W、Y、Z、X | |
| B. | 简单气态氢化物的稳定性由强到弱的顺序:Y、Z、W | |
| C. | 在化合物Y2X2、Z2X4分子中含有的共用电子对数相等 | |
| D. | 在元素W、Y、Z中,最高价氧化物的水化物酸性最强的是W |
14.如果敞口放置下列各物质,其中不会变质的是( )
| A. | 过氧化钠 | B. | 氯化钠 | C. | 漂白粉 | D. | 新制氯水 |
 图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: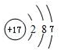 ,最高价氧化物的化学式为:Cl2O7.
,最高价氧化物的化学式为:Cl2O7.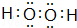 .
.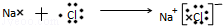 .
.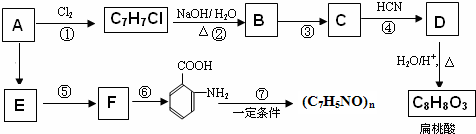
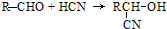
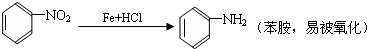
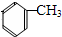 ;扁桃酸
;扁桃酸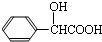 .
. .
. .
.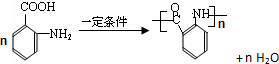 .
.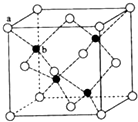 E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为Nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为Nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.