题目内容
14.如果敞口放置下列各物质,其中不会变质的是( )| A. | 过氧化钠 | B. | 氯化钠 | C. | 漂白粉 | D. | 新制氯水 |
分析 变质是指发生化学变化,生成新的物质,主要是和空气中的氧气、水蒸气、二氧化碳发生反应、见光反应而变质,据此解答.
解答 解:A.过氧化钠和空气中的二氧化碳、水蒸气发生反应变质,故A不选;
B.氯化钠性质稳定在空气中放置,与空气的物质不会反应,不会变质,故B选;
C.漂白粉是氯化钙和次氯酸钙的混合物,其中次氯酸钙会吸收空气中二氧化碳和水蒸气反应生成次氯酸,次氯酸见光分解使漂白粉失效,故C不选;
D.新制氯水中的次氯酸见光分解,敞口放置会变质,故D不选,
故选B.
点评 本题考查了物质的常见性质,熟悉氯化钠、氯水中次氯酸、漂白粉、过氧化钠的性质是解题关键,侧重考查学生对基础知识的掌握,注意变质的理解,题目难度不大.

练习册系列答案
相关题目
4.室温时,向10mL的醋酸稀溶液中逐滴滴入NaOH稀溶液至过量,有关叙述正确的是( )
| A. | 实验过程中水的电离程度的变化是先增大后减小 | |
| B. | 当溶液呈中性时,反应恰好完全 | |
| C. | 当反应恰好完全时,消耗NaOH溶液10mL | |
| D. | 当溶液呈碱性时,其中离子浓度由大到小的顺序可能为c(Na+)>c(OH-)>c(Ac-)>c(H+) |
5.将标准状况下的a L 氯化氢气体溶于1L 水中,得到的盐酸的密度为bg/mL,则该盐酸的物质的量的浓度是( )
| A. | $\frac{a}{22.4}$摩/升 | B. | $\frac{ab}{22400}$摩/升 | ||
| C. | $\frac{ab}{22400+36.5a}$摩/升 | D. | $\frac{1000ab}{22400+36.5a}$摩/升 |
2.下列事实不能用勒夏特列原理解释的是( )
| A. | 打开啤酒瓶盖,产生大量气泡 | |
| B. | 氢气与碘蒸气的平衡体系,加压后颜色加深 | |
| C. | 制取乙酸丁酯时,加入过量的乙酸 | |
| D. | 配制氯化铁溶液时,加入少量盐酸 |
9.组成生命细胞的11种宏量元素(约占人体总质量的99.97%),全部位于周期表的前20号.其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素.
(1)这六种元素中除H、C、O、P、S外,应该还有N(写元素符号),它的原子最外层共有5种不同运动状态的电子;与它同周期,且单质熔点最高的元素在周期表中的位置第二周期IVA族.
(2)糖类是人体获得能量的来源之一.已知1mol 葡萄糖在人体内完全氧化为二氧化碳和水,放出2804kJ的热量,该反应的热化学方程式C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l)△H=-2804kJ•mol-1.
(3)CO2是一种温室气体,它的电子式为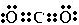 ,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.
,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.
(4)元素周期表中元素的性质存在递变规律,下列关系正确的是d(填序号).
a.离子半径:S2->Na+>O2->H+ b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3 d.还原性:PH3>H2S>HCl>HF
(5)表为部分非金属元素与氢形成共价键的键长与键能数据:
根据表中数据,归纳共价键键能与键长的关系同类分子中(同主族元素原子与相同其他原子等合理均可),键长越小,键能越大.
(1)这六种元素中除H、C、O、P、S外,应该还有N(写元素符号),它的原子最外层共有5种不同运动状态的电子;与它同周期,且单质熔点最高的元素在周期表中的位置第二周期IVA族.
(2)糖类是人体获得能量的来源之一.已知1mol 葡萄糖在人体内完全氧化为二氧化碳和水,放出2804kJ的热量,该反应的热化学方程式C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l)△H=-2804kJ•mol-1.
(3)CO2是一种温室气体,它的电子式为
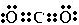 ,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.
,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.(4)元素周期表中元素的性质存在递变规律,下列关系正确的是d(填序号).
a.离子半径:S2->Na+>O2->H+ b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3 d.还原性:PH3>H2S>HCl>HF
(5)表为部分非金属元素与氢形成共价键的键长与键能数据:
| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 321 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
19.下列实验不能达到预期目的是( )
| 序号 | 实验操作 | 实验目的 |
| A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
| B | MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
| C | 测定Na2CO3、Na2SO4两溶液的pH | 比较碳、硫的非金属性强弱 |
| D | 用同一电路测定等浓度的盐酸、醋酸两溶液的导电性 | 比较盐酸、醋酸的酸性强弱 |
| A. | A | B. | B | C. | C | D. | D |
3.实验室有CO2(SO2)气体(括号内为杂质),下列选用的除杂试剂合理的是( )
| A. | BaCl2溶液 | B. | Ba(NO3)2溶液 | C. | 浓溴水 | D. | 饱和NaHCO3溶液 |
 )是一种化学活性很高的烃,存在于煤焦油中.
)是一种化学活性很高的烃,存在于煤焦油中. $\stackrel{室温}{→}$
$\stackrel{室温}{→}$ ,反应类型为加成;该反应的产物除
,反应类型为加成;该反应的产物除 外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式
外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式 ;
; )是双环戊二烯的一种同分异构体,它的一氯代物有4种.
)是双环戊二烯的一种同分异构体,它的一氯代物有4种.