题目内容
14. 图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:(1)该浓盐酸中HCl的物质的量浓度为12.0mol/L.
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是BD.
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.30mol/L稀盐酸.
①该学生需要量取12.5mL上述浓盐酸进行配制.
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)BCAFED.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,轻轻摇动容量瓶
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶的玻璃塞盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
③在配制过程中,下列操作会使所配制的稀盐酸物质的量浓度偏高的是BD.
A.用量筒量取浓盐酸时俯视观察凹液面
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻度线
D.在配置前用相同浓度的稀盐酸润洗容量瓶
(4)现将200mL 0.30mol/L的盐酸与50mL 0.80mol/L CaCl2溶液混合(混合后体积变化忽略不计),所得溶液中Cl-的物质的量浓度是0.56mol/L.
(5)在标准状况下,将352.8L HCl气体溶于1000mL水中(水的密度为1g/cm3),所得盐酸的密度为1.2g/cm3,溶质质量分数为36.5%.(保留小数点后一位)
分析 (1)根据c=$\frac{1000ρw}{M}$计算其浓度;
(2)盐酸溶液中,溶液浓度、溶液密度都与溶液体积大小无关,而氯化氢的物质的量、氯离子数目与溶液体积大小有关;
(3)①根据配制过程中溶质的物质的量不变计算出需要浓盐酸的体积;
②根据配制溶液的实验操作过程进行实验步骤排序;
③分析操作对溶质物质的量、溶液体积的影响,根据c=$\frac{n}{V}$判断对所配溶液浓度的影响;
(4)根据Cl-的物质的量守恒计算;
(5)根据n=$\frac{V}{Vm}$,w=$\frac{n•M}{n•M+1000}$计算;
解答 解:(1)浓盐酸中HCl的物质的量浓度为c=$\frac{1000ρw}{M}$=$\frac{1000×1.20×36.5%}{36.5}$=12.0mol/L;
故答案为:12.0mol/L;
(2)A.溶液中HCl的物质的量大小取决于溶液体积大小和溶液浓度,故A错误;
B.溶液具有均一性,溶液的浓度与溶液体积大小无关,故B正确;
C.溶液中Cl-的数目与溶液浓度、溶液体积大小及溶质化学式组成有关,故C错误;
D.溶液具有均一性,溶液的密度与溶液体积大小无关,故D正确;
故答案为:BD;
(3)①配制500mL物质的量浓度为0.30mol/L稀盐酸,配制过程中溶质的物质的量不变,设量取浓盐酸的体积为V,12.0mol/L×V=0.5L×0.30mol/L,V=0.0125L=12.5mL,故答案为:12.5;
②操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,其正确的操作顺序是BCAFED;
故答案为:BCAFED;
③A.用量筒量取浓盐酸时俯视观察凹液面,量取浓盐酸的体积偏小,溶质的物质的量偏小,所配溶液浓度偏低,故A错误;
B.溶液注入容量瓶前没有恢复到室温就进行定容,导致溶液的体积偏小,所配溶液浓度偏大,故B正确;
C.定容时仰视刻度线,导致溶液的体积偏大,所配溶液浓度偏低,故C错误;
D.在配置前用相同浓度的稀盐酸润洗容量瓶,导致溶质的物质的量偏大,所配溶液浓度偏大,故D正确;
故选:BD;
(4)将200mL0.30mol/L的盐酸与50mL0.80mol/LCaCl2溶液混合,所得溶液中Cl-的物质的量浓度为c=$\frac{n}{V}$=$\frac{0.2L×0.30mol/L+0.05L×0.80mol/L×2}{0.2L+0.05L}$=0.56mol/L,
故答案为:0.56;
(5)假设需要HCl的体积为V,则有w=$\frac{n•M}{n•M+1000}$×100%=$\frac{\frac{V}{22.4}×36.5}{\frac{V}{22.4}×36.5+1000}$×100%=36.5%,解得:V=352.8L;
故答案为:352.8;
点评 本题考查物质的量的浓度计算及溶液的配制,题目难度中等,且较为综合,注意有关计算公式的运用,把握溶液的配制方法.

| A. | NaF 的水解产物是NaOH 和HF | B. | CaO2 的水解产物是Ca(OH)2 和H2O2 | ||
| C. | PCl3 的水解产物之一是PH3 | D. | Mg3N2水解产物是Mg(OH)2和NH3 |
| A. | 正反应生成NO2的速率和逆反应生成O2的速率相等 | |
| B. | 反应容器中密度不随时间变化而变化 | |
| C. | 混合气体颜色深浅保持不变 | |
| D. | NO2、NO、O2的物质的量浓度之比为2:2:1 |
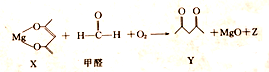
下列有关该反应的说法正确的是( )
| A. | X 是还原剂 | B. | Y的分子式为C5H8O2 | ||
| C. | Z的摩尔质量为44g | D. | 除去1mol甲醛时,转移2mole- |
| A. | 实验过程中水的电离程度的变化是先增大后减小 | |
| B. | 当溶液呈中性时,反应恰好完全 | |
| C. | 当反应恰好完全时,消耗NaOH溶液10mL | |
| D. | 当溶液呈碱性时,其中离子浓度由大到小的顺序可能为c(Na+)>c(OH-)>c(Ac-)>c(H+) |
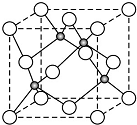 原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时成对电子数是其未成对电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题:
原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时成对电子数是其未成对电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题: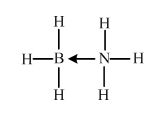 (必须标明配位键)
(必须标明配位键) ;
;