题目内容
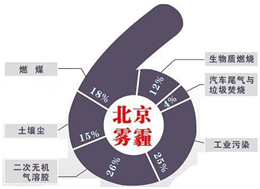 中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5化学组成及来源的季节变化研究发现,北京PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5化学组成及来源的季节变化研究发现,北京PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.(1)用于净化汽车尾气的反应为:
2NO(g)+2CO(g)
| ||
A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
B.提高尾气净化效率的常用方法是升高温度
C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率
D.提高尾气净化效率的最佳途径是使用高效催化剂
(2)CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题.镍与CO反应的化学方程式为Ni(s)+4CO(g)?Ni(CO)4(g),镍与CO反应会造成镍催化剂中毒.为防止镍催化剂中毒,工业上常用SO2除去CO,生成物为S和CO2.已知相关反应过程的能量变化如图1所示
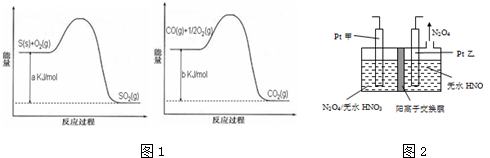
则用SO2除去CO的热化学方程式为
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.发生的化学反应是:2NH3(g)+NO(g)+NO2(g)
| ||
| 催化剂 |
(4)利用ClO2氧化氮氧化物反应过程如下:
NO
| ClO2 |
| 反应Ⅰ |
| Na2SO3水溶液 |
| 反应Ⅱ |
反应Ⅰ的化学方程式是2NO+ClO2+H2O═NO2+HNO3+2HCl,反应Ⅱ的离子方程式是
(5)工业废气中含有的NO2还可用电解法消除.用NO2为原料可制新型绿色硝化剂N2O5.制备方法之一是先将NO2转化为N2O4,然后采用电解法制备N2O5,装置如图2所示.
Pt乙为
考点:常见的生活环境的污染及治理,化学方程式的有关计算,反应热和焓变,化学平衡的影响因素,电解原理
专题:化学反应中的能量变化,电化学专题,元素及其化合物
分析:(1)A、反应是可逆反应,不能进行彻底;
B、尾气温度已经很高,再升高温度的意义不大;
C、从平衡常数分析反应进行程度,净化设备经济效益分析;
D、提高净化速率的最好方法是使用高效催化剂.
(2)依据图象书写热化学方程式,根据盖斯定律计算得到.
(3)使化学平衡向正反应方向移动可以提高氮氧化物的转化率.
(4)根据二氧化氮具有氧化性,能氧化Na2SO3生成Na2SO4,本身被还原成氮气;通过化学方程式建立关系式然后计算;
(5)由N2O4制取N2O5需要是去电子,所以N2O5在阳极区生成,Pt甲为阳极.
B、尾气温度已经很高,再升高温度的意义不大;
C、从平衡常数分析反应进行程度,净化设备经济效益分析;
D、提高净化速率的最好方法是使用高效催化剂.
(2)依据图象书写热化学方程式,根据盖斯定律计算得到.
(3)使化学平衡向正反应方向移动可以提高氮氧化物的转化率.
(4)根据二氧化氮具有氧化性,能氧化Na2SO3生成Na2SO4,本身被还原成氮气;通过化学方程式建立关系式然后计算;
(5)由N2O4制取N2O5需要是去电子,所以N2O5在阳极区生成,Pt甲为阳极.
解答:
解:(1)A.该反应为可逆反应,不能完全转化,排出的气体中一定含有NO或CO,故A错误;
B.尾气温度已经很高,再升高温度,反应速率提高有限,且消耗更多能源,意义不大,故B错误;
C、因平衡常数已经较大,增大压强虽然平衡正向移动,但对设备要求更高,不符合生成经济效益,故C错误;
D、研制高效催化剂可提高反应速率,解决反应极慢的问题,有利于尾气的转化,故C正确;
故选:D;
(2)图1:S(s)+O2(g)=SO2(g)△H1=-aKJ/mol
图2CO(g)+
O2(g)=CO2(g)△H2=-bKJ/mol;
依据盖斯定律②×2-①得到:SO2(g)+2CO(g)=S(s)+CO2(g)△H=2△H2-△H1=-(2b-a)KJ/mol,
故答案为:SO2(g)+2CO(g)=S(s)+CO2(g)△H=-(2b-a)KJ/mol;
(3)使化学平衡向正反应方向移动可以提高氮氧化物的转化率,增加反应物浓度平衡正向移动,所以可以采取增大NH3浓度的措施,由于此反应为放热反应,降低温度平衡正向移动,此反应正反应方向为气体体积增大的方向,减小压强平衡正向移动,
故答案为:增大NH3浓度(或减小压强、降低温度);
(4)二氧化氮具有氧化性,能氧化Na2SO3生成Na2SO4,本身被还原成氮气,方程式为2NO2+4Na2SO3═N2+4Na2SO4,
由2NO+ClO2+H2O═NO2+HNO3+2HCl,2NO2+4Na2SO3═N2+4Na2SO4得:
4NO~N2
30×4g 22.4L
60g 11.2L
所以共消耗NO60g,
故答案为:2NO2+4Na2SO3═N2+4Na2SO4;60;
(5)N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,因此Pt甲为阳极,pt乙即为阴极,阳极反应式为N2O4+2HNO3-2e-=2N2O5+2H+,
故答案为:阴;N2O4+2HNO3-2e-=2N2O5+2H+.
B.尾气温度已经很高,再升高温度,反应速率提高有限,且消耗更多能源,意义不大,故B错误;
C、因平衡常数已经较大,增大压强虽然平衡正向移动,但对设备要求更高,不符合生成经济效益,故C错误;
D、研制高效催化剂可提高反应速率,解决反应极慢的问题,有利于尾气的转化,故C正确;
故选:D;
(2)图1:S(s)+O2(g)=SO2(g)△H1=-aKJ/mol
图2CO(g)+
| 1 |
| 2 |
依据盖斯定律②×2-①得到:SO2(g)+2CO(g)=S(s)+CO2(g)△H=2△H2-△H1=-(2b-a)KJ/mol,
故答案为:SO2(g)+2CO(g)=S(s)+CO2(g)△H=-(2b-a)KJ/mol;
(3)使化学平衡向正反应方向移动可以提高氮氧化物的转化率,增加反应物浓度平衡正向移动,所以可以采取增大NH3浓度的措施,由于此反应为放热反应,降低温度平衡正向移动,此反应正反应方向为气体体积增大的方向,减小压强平衡正向移动,
故答案为:增大NH3浓度(或减小压强、降低温度);
(4)二氧化氮具有氧化性,能氧化Na2SO3生成Na2SO4,本身被还原成氮气,方程式为2NO2+4Na2SO3═N2+4Na2SO4,
由2NO+ClO2+H2O═NO2+HNO3+2HCl,2NO2+4Na2SO3═N2+4Na2SO4得:
4NO~N2
30×4g 22.4L
60g 11.2L
所以共消耗NO60g,
故答案为:2NO2+4Na2SO3═N2+4Na2SO4;60;
(5)N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,因此Pt甲为阳极,pt乙即为阴极,阳极反应式为N2O4+2HNO3-2e-=2N2O5+2H+,
故答案为:阴;N2O4+2HNO3-2e-=2N2O5+2H+.
点评:本题涉及热化学方程式的计算、化学平衡移动、电解原理、氧化还原原理等知识点,题目综合性程度一般,难度中等,掌握好原理是关键.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
下列各组物质的关系的描述不正确的是( )
| A、O2与O3互为同素异形体 |
B、CH2=CH2与  互为同系物. 互为同系物. |
| C、1H、2H、3H互为同位素 |
D、 与 与  互为同分异构体 互为同分异构体 |
下列说法正确的是( )
| A、0.1mol/LCH3COOH溶液加水稀释,溶液中c(OH-)增大 | ||
B、将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的
| ||
| C、相同浓度的HCl和CH3COOH,两溶液中c(H+)相同 | ||
| D、若HA、HB均为弱酸,酸性HA>HB,则相同条件下,溶液的pH大小为NaA>NaB |
利用如图所示实验装置进行实验,下列说法正确的是( )


| A、电子将沿着Zn→a→b→Cu路径流动 |
| B、片刻后可观察到试纸a点变蓝色 |
| C、反应一段时间,乙池溶液浓度上升 |
| D、锌电极上发生氧化反应 |
下列化学反应的离子方程式正确的是( )
| A、将铜屑加入Fe3+溶液中:2Fe3++Cu=2Fe2++Cu2+ |
| B、向氢氧化钠溶液中通入少量CO2:CO2+OH-=HCO3- |
| C、铝片放入NaOH溶液中:2OH-+Al=AlO2-+H2↑ |
| D、往碳酸钙中滴加稀盐酸:CO32-+2H+=CO2↑+H2O |
 如图是由一些常见元素组成的单质及其化合物之间的转化关系图.常温常压下,D、F均为无色无味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体;G是一种红褐色沉淀,且G、H、I、J中都含有同一种元素(反应中生成的部分物质已略去).请回答下列问题:
如图是由一些常见元素组成的单质及其化合物之间的转化关系图.常温常压下,D、F均为无色无味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体;G是一种红褐色沉淀,且G、H、I、J中都含有同一种元素(反应中生成的部分物质已略去).请回答下列问题:
 四川盛产五倍子.以五倍子为原料可以制得化合物A.A的结构简式如图所示:请回答下列问题:
四川盛产五倍子.以五倍子为原料可以制得化合物A.A的结构简式如图所示:请回答下列问题: