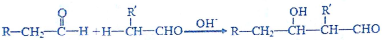题目内容
15.利用下列实验装置能完成相应实验的是( )| A. |  除去Cl2中的HCl | B. |  实验室制氨气 | ||
| C. |  制取并收集HCl | D. |  证明乙醇发生消去反应生成了乙烯 |
分析 A.氯气难溶于饱和食盐水;
B.氯化铵加热反应生成氨气和氯化氢,温度稍低时又生成氯化铵;
C.易产生倒吸现象;
D.乙烯中混有乙醇,乙醇也可被高锰酸钾氧化.
解答 解:A.氯气难溶于饱和食盐水,可用饱和食盐水除杂,故A正确;
B.氯化铵加热反应生成氨气和氯化氢,温度稍低时又生成氯化铵,实验室一般用氯化铵和氢氧化钙制备氨气,故B错误;
C.导管插入氢氧化钠溶液中,易产生倒吸现象,故C错误;
D.乙烯中混有乙醇,乙醇也可被高锰酸钾氧化,应先通过水洗气,故D错误.
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及物质分离和提纯、气体制备以及物质的检验等知识点,侧重考查学生分析及知识综合运用、实验操作能力,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.“银针验毒”在我国有上千年历史,银针主要用于检验是否有含硫元素的有毒物质.其反应原理之一为:Ag+2H2S+O2→Ag2S+H2O.当银针变色后,将其置于盛有食盐水的铝制容器中一段时间后便可复原.以下说法不正确的是( )
| A. | 当银针变黑时,所检验的物质有毒 | |
| B. | 银针验毒时,Ag被氧化 | |
| C. | 上述验毒反应的氧化产物和还原产物的物质的量之比为1:1 | |
| D. | 银针复原发生的反应可能为:3Ag2S+2Al═6Ag+Al2S3 |
6.下列指定反应的离子方程式正确的是( )
| A. | 向碳酸钠溶液中加入过量醋酸:CO32-+2H+═H2O+CO2↑ | |
| B. | 向偏铝酸钠溶掖中通入过量二氧化碳;CO2+2H2O+AlO2-═Al(OH)3↓+HCO3- | |
| C. | 向莫尔盐[(NH4)2Fe(SO4)2•6H2O]溶液中加入过量氧氧化钠溶液:NH4++Fe2++3OH-═NH3•H2O+Fe(OH)2↓ | |
| D. | 向双氧水中加入酸性高锰酸钾溶液:5H2O2+2MnO4-═2Mn2++5O2↑+6OH-+2H2O |
10.化学与生活、生产、可持续发展密切相关,下列说法正确的是( )
| A. | 14C可用于文物年代的鉴定,14C和12C互为同素异形体 | |
| B. | 在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 | |
| C. | 现代工业生产中芳香烃主要来源于石油化工的催化重整和煤的干馏 | |
| D. | 高纯度的SiO2可以制成光电池将光能直接转换为化学能 |
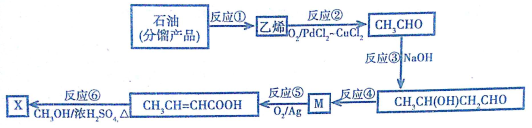
20.钴(Co)是重要的稀有金属,在工业和科技领域具有广泛的用途.从某含钴工业废料中回收钴的工艺流程如图:
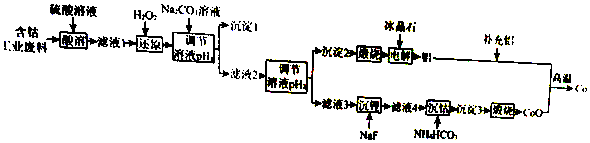
已知:
Ⅲ.离子浓度小于等于1.0×10-5mol•L-1时,认为该离子沉淀完全.
请回答下列问题:
(1)NaF的电子式为Na+[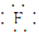 ]-.
]-.
(2)“沉淀1”的化学式为Fe(OH)3.“调节溶液pH2”的范围为4.7≤pH2<7.15.
(3)“还原”时发生反应的离子方程式为2CO3++H2O2=2CO2++O2↑2H+.“沉钴”时发生反应的离子方程式为CO2++2HCO3-=COCO3↓+CO2↑+H2O.
(4)制备Co时,“补充铝”的原因为原混合物中Al和Co的物质的量之比小于2:3.
(5)已知:l0-0.9≈0.13,则 A1(OH)3 的溶度积常数 Ksp=1.3×10-33.
(6)Li-SOCl2电池可用于心脏起搏器,该电池的总反应可表示为::4Li+2SOCl2═4LiCl+S+SO2,其正极反应式为2SOCl2+4e-=S+SO2+4Cl-.

已知:
| 含钴废料的成分 | |||||
| 成分 | Al | Li | Co2O3 | Fe2O3 | 其他不溶于强酸的杂质 |
| 质量分数/% | 10.5 | 0.35 | 65.6 | 9.6 | 13.95 |
| Ⅱ.实验中部分离子开始沉淀和沉淀完全的pH | |||
| 金属离子 | Fe3+ | Co2+ | Al3+ |
| 开始沉淀的pH | 1.9 | 7.15 | 3.4 |
| 沉淀完全的pH | 3.2 | 9.15 | 4.7 |
请回答下列问题:
(1)NaF的电子式为Na+[
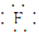 ]-.
]-.(2)“沉淀1”的化学式为Fe(OH)3.“调节溶液pH2”的范围为4.7≤pH2<7.15.
(3)“还原”时发生反应的离子方程式为2CO3++H2O2=2CO2++O2↑2H+.“沉钴”时发生反应的离子方程式为CO2++2HCO3-=COCO3↓+CO2↑+H2O.
(4)制备Co时,“补充铝”的原因为原混合物中Al和Co的物质的量之比小于2:3.
(5)已知:l0-0.9≈0.13,则 A1(OH)3 的溶度积常数 Ksp=1.3×10-33.
(6)Li-SOCl2电池可用于心脏起搏器,该电池的总反应可表示为::4Li+2SOCl2═4LiCl+S+SO2,其正极反应式为2SOCl2+4e-=S+SO2+4Cl-.
4.化学与科技、生活密切相关.下列说法错误的是( )
| A. | 肥皂水、矿泉水及食醋三种溶液的pH依次减小 | |
| B. | 高铁车厢采用的铝合金材料强度大、质量轻,不与氧气反应 | |
| C. | 食品袋中放入盛有硅胶和铁粉的透气小袋,是为了防止食物受潮、氧化变质 | |
| D. | 采用“静电除尘”、“汽车尾气催化净化”等方法可减少“雾霾”的发生 |