题目内容
10.化学与生活、生产、可持续发展密切相关,下列说法正确的是( )| A. | 14C可用于文物年代的鉴定,14C和12C互为同素异形体 | |
| B. | 在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 | |
| C. | 现代工业生产中芳香烃主要来源于石油化工的催化重整和煤的干馏 | |
| D. | 高纯度的SiO2可以制成光电池将光能直接转换为化学能 |
分析 A.14C具有放射性,14C和12C均为C原子;
B.电化学腐蚀更普遍;
C.石油化工的催化重整和煤的干馏可获得芳香烃;
D.Si为常见的半导体材料.
解答 解:A.14C具有放射性,可用于文物年代的鉴定,14C和12C均为C原子,为同位素,故A错误;
B.电化学腐蚀更普遍,则在日常生活中,电化学腐蚀是造成钢铁腐蚀的主要原因,故B错误;
C.我国为化石能源为主的国家,现代工业生产中芳香烃主要来源于石油化工的催化重整和煤的干馏,故C正确;
D.Si为常见的半导体材料,则Si可以制成光电池将光能直接转换为化学能,故D错误;
故选C.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,注意材料、能源及化学的联系,题目难度不大.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
20.根据下列实验操作和实验现象所得结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向石蕊溶液中滴加氯水至足量 | 石蕊溶液先变红再褪色 | Cl2有酸性和漂白性 |
| B | 向大豆油、煤油中分别加入足量NaOH溶液,充分加热 | 一种液体仍然分层,另一种液体不再分层 | 分层者为煤油,不分层者为大豆油 |
| C | 向某溶液中加入足量盐酸 | 生成白色沉淀 | 该溶液中含有Ag+ |
| D | 用容量瓶配制一定物质的量浓度的K2SO4溶液,定容后反复摇匀 | 液面低于刻度线 | 所配溶液浓度偏高 |
| A. | A | B. | B | C. | C | D. | D |
18.短周期元素A、B、C、D的原子序数依次增大,A的L层电子数是K层的3倍,D所在 族序数是周期数的2倍,B、C、D的最外层电子数之和为10.下列说法正确的是( )
| A. | B可以从溶液中置换出C单质 | |
| B. | 简单离子半径:D>A>B>C | |
| C. | A和D形成的化合物溶于水可导电,所以该化合物为电解质 | |
| D. | 最高价氧化物对应的水化物的酸性:A>D |
15.利用下列实验装置能完成相应实验的是( )
| A. |  除去Cl2中的HCl | B. |  实验室制氨气 | ||
| C. |  制取并收集HCl | D. |  证明乙醇发生消去反应生成了乙烯 |
2.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 80℃时,1L pH=1的硫酸溶液中,含有的OH-数目为10-13NA | |
| B. | 含0.1mol NH4HSO4的溶液中,阳离子数目略小于0.2NA | |
| C. | C3H8分子中的2个H原子分别被1个-NH3和1个-OH取代,1mol此有机物所含共同电子对数目为13NA | |
| D. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子 |
19.X、Y、Z、W、Q是短周期主族元素,其中X原子最外层电子数是内层电子数的3倍;X与Z同主族,Y与Z同周期,Q原子的电子总数等于其电子层数的3倍,W与X、Y既不同族也不同周期;X、Y、Z三种元素的族序数之和为16.下列说法正确的是( )
| A. | Z与Q形成化合物的电子式为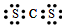 | |
| B. | X与Z、Q形成的化合物均为大气污染物 | |
| C. | Q与W能形成10电子、14电子、18电子分子 | |
| D. | Y、Z、Q分别与X只能组成化学式为AB2型化合物 |
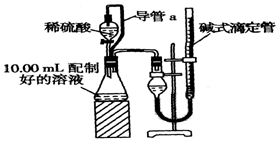 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0溶于水中,配成250mL溶液.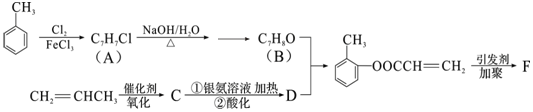
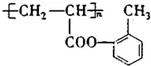
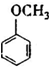 (填结构简式).
(填结构简式).