题目内容
17.含有极性键且分子中各原子都满足8电子稳定结构的化合物是( )| A. | CH4 | B. | CH2═CH2 | C. | CO2 | D. | N2 |
分析 不同原子间形成极性键,同种原子间形成非极性键;对于ABn共价化合物,各元素满足|化合价|+元素原子的最外层电子数=8,原子都满足最外层8电子结构,化合物中氢原子属于2电子稳定结构,据此判断.
解答 解:A.CH4分子中存在C-H极性键;CH4中C元素化合价为-4,C原子最外层电子数为4,所以|-4|+4=8,分子中C原子满足8电子结构;H原子不满足8电子结构,故A错误;
B.CH2=CH2分子中C-H极性键;CH2=CH2分子中H原子不满足8电子结构,故B错误;
C.CO2分子中存在C=O极性键;CO2中C元素化合价为+4,C原子最外层电子数为4,所以4+4=8,分子中C原子满足8电子结构;O元素化合价为-2,O原子最外层电子数为6,所以|-2|+6=8,分子中O原子满足8电子结构,故C正确;
D.N2分子中存在N≡N非极性键;N原子满足8电子稳定结构,但是N2是单质,不是化合物,不符合题意,故D错误;
故选C.
点评 本题考查8电子结构以及极性键的判断,难度不大,清楚元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构是关键,注意单质和离子化合物不适合.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
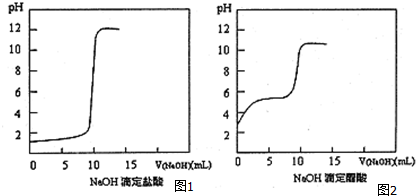
7.常温下,下列有关离子浓度及pH大小的比较正确的是( )
| A. | NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序为③>②>① | |
| B. | 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积和混合,其离子浓度不可能是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | pH=13的Ba(OH)2溶液与pH=1的盐酸等体积混合,混合溶液的 pH>7 | |
| D. | pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13.7 |
8.下表为各物质中所含有的少量杂质,以及除去这些杂质应选用的试剂或操作方法.其中正确的是( )
| 选项 | A | B | C | D |
| 物质 | KNO3溶液 | CO2 | 水 | 乙醇 |
| 杂质 | KOH | H2O(g) | 溴 | 水 |
| 除杂试剂 | FeCl3溶液 | 浓硫酸 | 酒精 | 生石灰 |
| 除杂装置 | 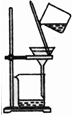 | 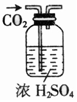 | 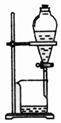 | 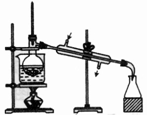 |
| A. | A | B. | B | C. | C | D. | D |
12.下列化合物的分子中,所有原子都处于同一平面的有( )
| A. | 乙烷 | B. | 甲苯 | C. | CH2=CH-CN | D. | 异戊二烯 |
9.关于下列四个图象的说法不正确的是( )
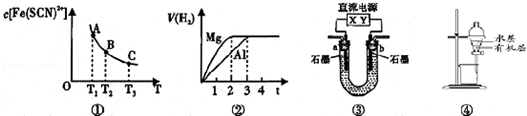

| A. | 已知图①是体系Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)中的c[Fe(SCN)2+]与温度T的平衡图象,A点与B点相比,A点的c(Fe3+)更小 | |
| B. | 图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V 与时间t的关系.则反应中镁和铝的反应速率之比为2:3 | |
| C. | 图③直流电源Y极为正极,U形管中为AgNO3溶液,则b管中电极反应式是:4OH--4e-═O2↑+2H2O | |
| D. | 图④表示分离CCl4萃取碘水后已分层的有机层和水层 |
10.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:K=$\frac{c({H}_{2}C(CO))}{C({H}_{2}O)}$,它所对应的化学方程式为:C(s)+H2O(g)?CO(g)+H2(g)
(2)已知在400℃时,N2 (g)+3H2(g)?2NH3(g)△H<0 的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正=V(N2)逆(填:>、<、=、不能确定).
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是a(填序号)
a.缩小体积增大压强 b.升高温度 c.加催化剂 d.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:A(g)+3B(g)?2C(g)+D(s)△H,其化学平衡常数K与温度t的关系如下表:
请完成下列问题:
①判断该反应的△H>0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是cd(填序号).
a.3v(B)(正)=2v(C)(逆)b.A和B的转化率相等
c.容器内压强保持不变 d.混合气体的密度保持不变.
(1)已知某反应的平衡表达式为:K=$\frac{c({H}_{2}C(CO))}{C({H}_{2}O)}$,它所对应的化学方程式为:C(s)+H2O(g)?CO(g)+H2(g)
(2)已知在400℃时,N2 (g)+3H2(g)?2NH3(g)△H<0 的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正=V(N2)逆(填:>、<、=、不能确定).
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是a(填序号)
a.缩小体积增大压强 b.升高温度 c.加催化剂 d.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:A(g)+3B(g)?2C(g)+D(s)△H,其化学平衡常数K与温度t的关系如下表:
| t/K | 300 | 400 | 500 | … |
| K/(mol•L-1)2 | 4×106 | 8×107 | K1 | … |
①判断该反应的△H>0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是cd(填序号).
a.3v(B)(正)=2v(C)(逆)b.A和B的转化率相等
c.容器内压强保持不变 d.混合气体的密度保持不变.
 .
.
 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.