题目内容
5.现利用pH传感器和数据采集器等探究强碱和不同的酸中和反应的过程如下:(1)实验步骤:
①分别配制浓度均为0.1000mol•L-1250mL的NaOH、HCl、CH3COOH溶液备用.配制过程中用到玻璃仪器有量筒、烧杯、容量瓶、玻璃棒、细口瓶、胶头滴管.
②在锥形瓶中加入l0mL0.1mol•L-1的HCl,在25.00mL碱式(填“酸式”、“碱式”)滴定管中加入0.1mol•L-1的NaOH,连接数据采集器和pH传感器.
③向锥形瓶中滴入NaOH,接近估算的NaOH用量附近时,减慢滴加速度,等读数稳定后,再滴下一滴NaOH.存储计算机绘制的pH变化图.用0.lmol•L-1的CH3COOH溶液代替HCl重复上述②~③的操作.
(2)结果分析:20℃时NaOH分别滴定HCl、CH3COOH的pH变化曲线如图1,2.
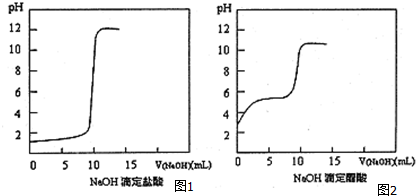
根据上述曲线回答下列问题:
①用0.lmol•L-1的CH3COOH溶液代替HCl滴定时选用酚酞做指示剂.
②测得醋酸起点pH为3,则20℃时该浓度醋酸的电离度为1%;
③盐酸恰好反应时pH=7,而醋酸恰好反应时pH=8左右的原因是中和后生成的醋酸钠水解使溶液显碱性.
分析 (1)①根据溶液的配制过程选择仪器;
②NaOH溶液应该用碱式滴定管量取;
(2)①如用醋酸,滴定终点呈碱性;
②根据图象可知0.1mol•L-1的醋酸,其PH为3,然后求出电离度;
③根据盐类的水解原理分析.
解答 解:(1)①配制过程中用到玻璃仪器有量筒、烧杯、容量瓶、玻璃棒、细口瓶,在定容时需要胶头滴管,故答案为:胶头滴管;
②NaOH溶液能腐蚀酸式滴定管中的活塞,所以要用碱式滴定管,故答案为:碱式;
(2)①如用醋酸,滴定终点生成醋酸钠,呈碱性,应用酚酞为指示剂,故答案为:酚酞;
②根据图象可知0.1mol•L-1的醋酸,其PH为3,所以c(H+)=10-3mol/L,故电离度=$\frac{1{0}^{-3}}{0.1}$×100%=1%,故答案为:1%;
③醋酸与氢氧化钠反应生成CH3COONa为强碱弱酸盐,水解显碱性,所以其水溶液PH大于7,故答案为:中和后生成的醋酸钠水解使溶液显碱性.
点评 本题考查了中和滴定实验,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,题目涉及弱酸的电离,盐类的水解,难度中等,要注意滴定管的选择.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
12.下列说法正确的是( )
| A. | 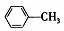 的一溴代物和 的一溴代物和 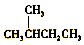 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) | |
| B. | C5H11Cl有3种同分异构体 | |
| C. | 按系统命名法,化合物 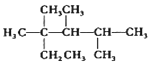 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| D. | CH3CH═CHCH3分子中的四个碳原子在同一直线上 |
13.一定条件下反应N2(g)+3H2(g)?2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内H2的反应速率为( )
| A. | 1.2mol/(L•min) | B. | 1.8 mol/(L•min) | C. | 0.6mol/(L•min) | D. | 2.4mol/(L•min) |
10.下列化学用语使用正确的是( )
| A. | 淀粉的最简式:CH2O | B. | 邻羟基苯甲酸的结构简式: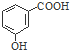 | ||
| C. | 2-乙基-1,3-丁二烯的键线式: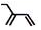 | D. | 苯分子球棍模型: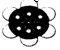 |
17.含有极性键且分子中各原子都满足8电子稳定结构的化合物是( )
| A. | CH4 | B. | CH2═CH2 | C. | CO2 | D. | N2 |
14.下表为元素周期表的一部分,请回答下列问题:
(1)③原子结构示意图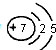 .
.
(2)⑥、⑦和⑧三种元素的最高价氧化物对应水化物酸性最强的是HClO4(填化学式)
(3)①和②元素的最高价氧化物对应水化物碱性最强是中NaOH(填化学式)
(4)⑧元素的单质与①元素的最高价氧化物对应水化物反应的化学方程式:Cl2+2NaOH═NaCl+NaClO+H2O.
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | ④ | ⑤ | |||||
| 3 | ① | ② | ⑥ | ⑦ | ⑧ | |||
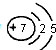 .
.(2)⑥、⑦和⑧三种元素的最高价氧化物对应水化物酸性最强的是HClO4(填化学式)
(3)①和②元素的最高价氧化物对应水化物碱性最强是中NaOH(填化学式)
(4)⑧元素的单质与①元素的最高价氧化物对应水化物反应的化学方程式:Cl2+2NaOH═NaCl+NaClO+H2O.
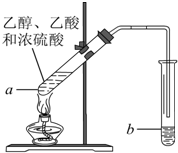 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.