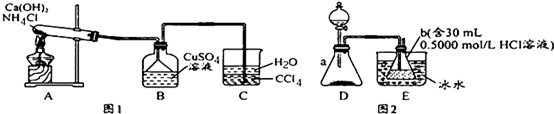
题目内容
8.下表为各物质中所含有的少量杂质,以及除去这些杂质应选用的试剂或操作方法.其中正确的是( )| 选项 | A | B | C | D |
| 物质 | KNO3溶液 | CO2 | 水 | 乙醇 |
| 杂质 | KOH | H2O(g) | 溴 | 水 |
| 除杂试剂 | FeCl3溶液 | 浓硫酸 | 酒精 | 生石灰 |
| 除杂装置 | 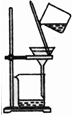 | 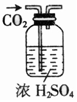 | 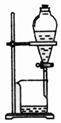 | 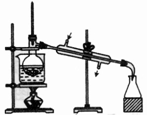 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.KOH与氯化铁反应生成沉淀和KCl;
B.浓硫酸可吸收水,与二氧化碳不反应,导管长进短出可洗气;
C.水与酒精互溶;
D.蒸馏时,温度计测定馏分的温度、冷水下进上出.
解答 解:A.KOH与氯化铁反应生成沉淀和KCl,引入新杂质KCl,不能除杂,故A错误;
B.浓硫酸可吸收水,与二氧化碳不反应,导管长进短出可洗气,图中装置合理,故B正确;
C.水与酒精互溶,不能利用图中分液装置分离,故C错误;
D.蒸馏时,温度计测定馏分的温度、冷水下进上出,图中温度计的水银球未在支管口处,冷水流向不合理,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯实验、实验装置、实验基本操作和基本技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
18.由硫酸钾、硫酸铝和硫酸组成的混合溶液,其c(H+)=0.1mol•L-1,c(Al3+)=0.4mol•L-1,c(SO42-)=0.8mol•L-1,则c(K+)为( )
| A. | 0.15mol•L-1 | B. | 0.2mol•L-1 | C. | 0.3mol•L-1 | D. | 0.4mol•L-1? |
19.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的有( )
①生成物的质量分数一定增加
②生成物的产量一定增大
③反应物的转化率一定增大
④正反应速率一定大于逆反应速率
⑤反应物的浓度一定降低
⑥使用了合适的催化剂.
①生成物的质量分数一定增加
②生成物的产量一定增大
③反应物的转化率一定增大
④正反应速率一定大于逆反应速率
⑤反应物的浓度一定降低
⑥使用了合适的催化剂.
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
16.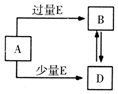 已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )
 已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )| A. | 若A是铁,则E可能为稀硝酸 | |
| B. | 若A是CuO,E是碳,则B为CO | |
| C. | 若A是NaOH溶液,E是CO2,则B为NaHCO3 | |
| D. | 若A是A1C13溶液,E可能是稀氨水 |
3.向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )
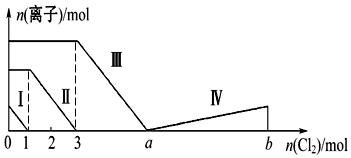

| A. | 线段Ⅱ表示Br-的变化情况 | B. | 原溶液中n(FeBr2):n(FeI2)=1:3 | ||
| C. | 线段Ⅳ表示IO3-的变化情况 | D. | 根据图象无法计算a的值 |
13.一定条件下反应N2(g)+3H2(g)?2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内H2的反应速率为( )
| A. | 1.2mol/(L•min) | B. | 1.8 mol/(L•min) | C. | 0.6mol/(L•min) | D. | 2.4mol/(L•min) |
20.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )
| A. | 1molN2与4molH2反应生成的NH3分子数为2NA | |
| B. | 14g乙烯和丙烯混合气体中的氢原子数为2NA | |
| C. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24LCCl4含有的共价键数为0.4NA |
17.含有极性键且分子中各原子都满足8电子稳定结构的化合物是( )
| A. | CH4 | B. | CH2═CH2 | C. | CO2 | D. | N2 |