题目内容
9.关于下列四个图象的说法不正确的是( )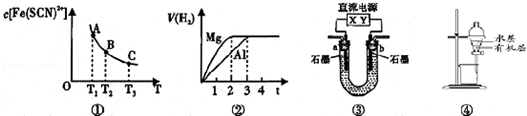
| A. | 已知图①是体系Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)中的c[Fe(SCN)2+]与温度T的平衡图象,A点与B点相比,A点的c(Fe3+)更小 | |
| B. | 图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V 与时间t的关系.则反应中镁和铝的反应速率之比为2:3 | |
| C. | 图③直流电源Y极为正极,U形管中为AgNO3溶液,则b管中电极反应式是:4OH--4e-═O2↑+2H2O | |
| D. | 图④表示分离CCl4萃取碘水后已分层的有机层和水层 |
分析 A.根据图象可知,A点与B点相比,A点的c[Fe(SCN)2+]大,可根据化学平衡判断;
B.根据图象中可知,反应中镁和铝的反应所需时间之比为2:3,判断其反应速率之比;
C.电源Y极为正极,则X极为负极,则b管中石墨是阳极,发生氧化反应;
D.CCl4的密度大于水.
解答 解:A.根据图象可知,A点与B点相比,A点的c[Fe(SCN)2+]大,说明A点相对于B点平衡右移,故A点c(Fe)3+小,故A正确;
B.根据图象中可知,反应中镁和铝的反应所需时间之比为2:3,可知其反应速率之比为3:2,故B错误;
C.电源Y极为正极,则X极为负极,与Y极相连的b管石墨是阳极,发生氧化反应,电极反应式是:4OH--4e-═O2↑+2H2O,故C正确;
D.CCl4的密度大于水,而且与水会分层,四氯化碳在下层,用分液漏斗分离,故D正确;
故选B.
点评 本题考查化学平衡图象问题,题目难度中等,本题注意分析图象中曲线的变化特征,把握温度对平衡移动的影响,此为解答该题的关键.

练习册系列答案
相关题目
16.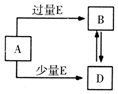 已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )
 已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )| A. | 若A是铁,则E可能为稀硝酸 | |
| B. | 若A是CuO,E是碳,则B为CO | |
| C. | 若A是NaOH溶液,E是CO2,则B为NaHCO3 | |
| D. | 若A是A1C13溶液,E可能是稀氨水 |
17.含有极性键且分子中各原子都满足8电子稳定结构的化合物是( )
| A. | CH4 | B. | CH2═CH2 | C. | CO2 | D. | N2 |
14.下表为元素周期表的一部分,请回答下列问题:
(1)③原子结构示意图 .
.
(2)⑥、⑦和⑧三种元素的最高价氧化物对应水化物酸性最强的是HClO4(填化学式)
(3)①和②元素的最高价氧化物对应水化物碱性最强是中NaOH(填化学式)
(4)⑧元素的单质与①元素的最高价氧化物对应水化物反应的化学方程式:Cl2+2NaOH═NaCl+NaClO+H2O.
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | ④ | ⑤ | |||||
| 3 | ① | ② | ⑥ | ⑦ | ⑧ | |||
 .
.(2)⑥、⑦和⑧三种元素的最高价氧化物对应水化物酸性最强的是HClO4(填化学式)
(3)①和②元素的最高价氧化物对应水化物碱性最强是中NaOH(填化学式)
(4)⑧元素的单质与①元素的最高价氧化物对应水化物反应的化学方程式:Cl2+2NaOH═NaCl+NaClO+H2O.
19.能正确表示下列反应的离子方程式为( )
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | |
| C. | NaClO和NaOH的混合溶液中通入少量的SO2:ClO-+H2O+SO2=C1-+SO42-+2H+ | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
 碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如下: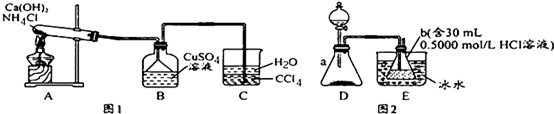
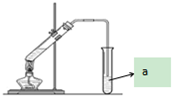 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: ,该反应类型为取代反应;该反应中浓硫酸的作用是催化剂和吸水剂;
,该反应类型为取代反应;该反应中浓硫酸的作用是催化剂和吸水剂;