题目内容
10.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:(1)已知某反应的平衡表达式为:K=$\frac{c({H}_{2}C(CO))}{C({H}_{2}O)}$,它所对应的化学方程式为:C(s)+H2O(g)?CO(g)+H2(g)
(2)已知在400℃时,N2 (g)+3H2(g)?2NH3(g)△H<0 的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正=V(N2)逆(填:>、<、=、不能确定).
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是a(填序号)
a.缩小体积增大压强 b.升高温度 c.加催化剂 d.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:A(g)+3B(g)?2C(g)+D(s)△H,其化学平衡常数K与温度t的关系如下表:
| t/K | 300 | 400 | 500 | … |
| K/(mol•L-1)2 | 4×106 | 8×107 | K1 | … |
①判断该反应的△H>0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是cd(填序号).
a.3v(B)(正)=2v(C)(逆)b.A和B的转化率相等
c.容器内压强保持不变 d.混合气体的密度保持不变.
分析 (1)根据平衡常数的定义判断反应的方程式;
(2)计算浓度商和平衡常数减小比较判断反应进行的方向,若Q=K,反应达到平衡,Q<K,反应正向进行,Q>K反应逆向进行;使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,需要改变条件 满足化学反应速率增大,且平衡正向进行;
(3)分析图表平衡常数温度升高,平衡常数增大,平衡正向进行,正反应为吸热反应;结合平衡移动原理分析,正逆反应速率相同,各组分含量保持不变分析选项.
解答 解:(1)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,平衡常数中,分子为生成物,分母为反应物,再结合质量守恒定律,所以该反应的方程式为C(s)+H2O(g)?CO(g)+H2(g),
故答案为:C(s)+H2O(g)?CO(g)+H2(g);
(2)一段时间后,当N2、H2、NH3的物质的量分别为2mol/L、1mol/L、2mol/L时,Qc=$\frac{4×4}{4×{2}^{3}}$=0.5,所以该状态是平衡状态,正逆反应速率相等,
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,
a.反应是气体体积减小的反应,缩小体积增大压强,反应速率增大,平衡逆向进行,故a正确;
b.反应是放热反应,升高温度,速率增大,平衡逆向进行,故b错误;
c.加催化剂改变反应速率,不改变平衡,故c错误;
d.使氨气液化移走,平衡正向进行,反应速率减小,故d错误;
故答案为:=;a;
(3)①图表分析可知,平衡常数随温度升高增大,说明正反应为吸热反应,△H>0,
故答案为:>;
②A(g)+3B(g)?2C(g)+D(s)△H>0,
a.反应速率之比等于化学方程式计量数之比,2v(B)(正)=3v(C)(逆),说明C的正逆反应速率相同,反应达到平衡状态,但3v(B)(正)=2v(C)(逆)不能说明反应达到平衡状态,故a错误;
b.A和B的转化率相等与起始量、变化量有关,不能说明反应达到平衡状态,故b错误;
c.反应前后气体体积减小,容器内压强保持不变,说明反应达到平衡状态,故c正确;
d.反应前后气体质量减小,体积不变,混合气体的密度保持不变说明反应达到平衡状态,故d正确;
故答案为:cd.
点评 本题考查根据化学平衡常数书写化学方程式、平衡移动相关计算等,题目较为综合,涉及多方面的知识,题目难度中等,注意平衡标志判断.

 阅读快车系列答案
阅读快车系列答案| A. | CH4 | B. | CH2═CH2 | C. | CO2 | D. | N2 |
N2(g)+3H2(g)?2NH3(g)+Q(Q>0),
(1)该反应450℃的平衡常数>500℃时的平衡常数(填“>”、“<”或“=”).该反应达到平衡时混合气体的平均式量的范围是8.5<平均式量<17
(2)下列描述中能说明上述反应已达平衡的是BD
A、3V正(H2)=2V逆(NH3) B、容器中气体的平均分子量不随时间而变化
C、容器中气体的密度不随时间而变化 D、容器中气体的分子总数不随时间而变化
如上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol,计算从反应开始到平衡时,平均反应速率v(N2)为0.02mol/(L.min).
(3)下列研究目的和示意图相符的是C.
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 | 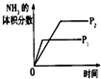 | 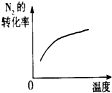 | 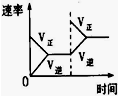 | 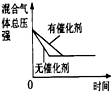 |
A、0.20mol/L B、0.16mol/L C、0.10mol/L D、0.05mol/L
在第5分钟末,保持其它条件不变,若继续通入0.2mol的N2和0.6mol的H2,则平衡向正反应方向移动(填“向正反应方向”“向逆反应方向”或“不”).
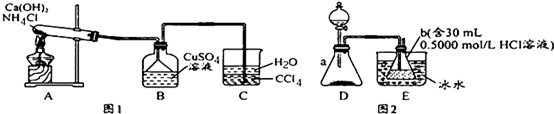
(1)仪器的洗涤:将2支滴定管和锥形瓶洗涤干净,滴定管还要润洗.
(2)在滴定管中装入相应的溶液,并记录好初读数
(3)用滴定管量取20.00ml的未知盐酸溶液于锥形瓶中,并加入2到3滴酚酞试液作为指示剂,振荡,摇匀.
(4)滴定操作:滴定时一手控制滴定管,一手摇动锥形瓶,眼睛观察锥形瓶内颜色的变化,当溶液颜色由无色变为浅红色,且半分钟内不变色时,则达滴定终点,记录读数.
(5)数据处理
| 实验次数 | 初读数(mL) | 末读数(mL) |
| 1 | 0.00 | 18.50 |
| 2 | 0.00 | 22.45 |
| 3 | 0.00 | 18.48 |
以上数据计算待测盐酸的物质的量浓度为0.1849mol/L.
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | |
| C. | NaClO和NaOH的混合溶液中通入少量的SO2:ClO-+H2O+SO2=C1-+SO42-+2H+ | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
| A. | Br2是氧化剂,NaOH是还原剂 | |
| B. | Br2既是氧化剂又是还原剂 | |
| C. | 被氧化的Br原子和被还原的Br原子的物质的量的比为5:1 | |
| D. | 每生成1mol的NaBrO3转移10mol的电子 |
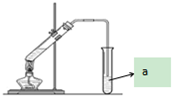 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: ,该反应类型为取代反应;该反应中浓硫酸的作用是催化剂和吸水剂;
,该反应类型为取代反应;该反应中浓硫酸的作用是催化剂和吸水剂;