题目内容
14.确定BF3和H2O的中心原子的杂化轨道类型,用计算来回答.分析 价层电子对互斥理论认为:分子的立体构型是“价层电子对”相互排斥的结果,先判断价层电子对数,再确定构型和杂化方式,由此分析解答.
解答 解:在BF3分子中B原子的价层电子对等于3,且没有孤电子对,所以中心原子的杂化轨道类型是sp2杂化;H2O分子中O原子的价层电子对等于2,且有两对孤电子对,所以中心原子的杂化轨道类型是sp3杂化,答:BF3分子的中心原子B原子上含有3个σ 键,中心原子B价层电子对数为$\frac{3+1×3}{2}$=3,属于sp2杂化,而H2O分子的中心原子O原子上含有2个σ 键,中心原子O价层电子对数为$\frac{6+1×2}{2}$=4,属于sp3杂化.
点评 本题考查了原子杂化方式的判断,根据价层电子对互斥理论分析解答即可,注意孤电子对个数的计算方法,为难点.

练习册系列答案
相关题目
4.下列说法不正确的是( )
| A. | 木材、纺织品浸过水玻璃后,具有防腐性能且不易燃烧 | |
| B. | 金属镁的熔点高达2800℃,是优质的耐高温材料 | |
| C. | 氧化铁红颜料跟某些油料混合,可以制成防锈油漆 | |
| D. | 由于铜盐能杀死某些细菌,并能抑制藻类生长,因此游泳场馆常用硫酸铜作池水消毒剂 |
2.使溶液中Al3+完全转化成Al(OH)3,应该选择的最好试剂是( )
| A. | HCl | B. | H2SO4 | C. | 氨水 | D. | NaOH |
19. 已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,如图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度.下列说法中,不正确的是( )
已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,如图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度.下列说法中,不正确的是( )
 已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,如图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度.下列说法中,不正确的是( )
已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,如图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度.下列说法中,不正确的是( )| A. | X表示温度 | B. | L2>L1 | C. | 反应速率 υ(M)>υ(N) | D. | 平衡常数 K(M)>K(N) |
6.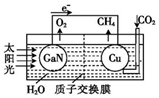 科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列说法不正确的是( )
科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列说法不正确的是( )
 科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列说法不正确的是( )
科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列说法不正确的是( )| A. | 该过程是将太阳能转化为化学能的过程 | |
| B. | GaN表面发生氧化反应:2H2O-4 e-═O2↑+4H+ | |
| C. | Cu表面的反应是:CO2+8e-+6H2O═CH4+8OH? | |
| D. | H+透过质子交换膜从左向右迁移 |
3.下列关于安全事故的处理方法中,正确的是( )
| A. | 皮肤上不慎沾上浓Na OH溶液,立即用稀硫酸冲洗 | |
| B. | 大量氯气泄漏时,应迅速离开现场,并尽快往高处去 | |
| C. | 不慎洒出的酒精在桌上着火时,立即用大量水扑灭 | |
| D. | 金属钠着火时,应立即用沾水的毛巾覆盖 |
4.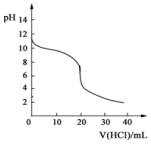 常温下,向20.00mL0.1000mol•L-1的氨水中逐滴加入0.1000mol•L-1的盐酸,pH随盐酸体积的变化如图所示.(不考虑NH3的逸出).下列说法不正确的是( )
常温下,向20.00mL0.1000mol•L-1的氨水中逐滴加入0.1000mol•L-1的盐酸,pH随盐酸体积的变化如图所示.(不考虑NH3的逸出).下列说法不正确的是( )
 常温下,向20.00mL0.1000mol•L-1的氨水中逐滴加入0.1000mol•L-1的盐酸,pH随盐酸体积的变化如图所示.(不考虑NH3的逸出).下列说法不正确的是( )
常温下,向20.00mL0.1000mol•L-1的氨水中逐滴加入0.1000mol•L-1的盐酸,pH随盐酸体积的变化如图所示.(不考虑NH3的逸出).下列说法不正确的是( )| A. | 反应过程中:c(NH4+)+c(H+)=c(OH-)+c(Cl-) | |
| B. | V(HCl)=10.00mL时,c(NH4+)>c(Cl-)>c(NH3•H2O) | |
| C. | V(HCl)<20.00mL时,溶液一定呈碱性 | |
| D. | V(HCl)=30.00mL时,2c(Cl-)=3c(NH4+)+3c(NH3•H2O) |