题目内容
5.①19.6克硫酸是0.2mol H2SO4,含有1.4NA个原子,1.7克NH3在同温同压下与5.1克H2S气体含有的氢原子数相同.②在标准状况下,1.6g某气态氧化物RO2体积为0.56L,该气体的物质的量是0.025mol摩尔质量是64g/mol,R的相对原子量为32
③已知Wg气体A含有a个分子,那么在标准状况下,bg气体A所占的体积是$\frac{22.4ab}{w{N}_{A}}$L (其中阿伏加德罗常数用NA表示)
④标准状况下,密度为0.75g/L的NH3与CH4组成的混合气体中,NH3的体积分数80%,混合气体的平均摩尔质量为16.8g/mol该气体对氢气的相对密度为8.4.
分析 ①硫酸的物质的量n=$\frac{m}{M}$;而硫酸为7原子分子,据此计算硫酸中的原子的物质的量和个数;求出氨气的物质的量,然后根据氨气中含3个H原子来计算出其含有的H原子的物质的量,然后根据H2S中含2个H原子,求出H2S的物质的量,并根据质量m=nM来计算;
②根据其体积求出物质的量,然后根据摩尔质量M=$\frac{m}{n}$计算;而相对分子质量在数值上等于摩尔质量,故R的相对原子质量=相对分子质量-32;
③Wg气体A含有a个分子,设bg气体含有的分子数为x个,则有:$\frac{wg}{bg}=\frac{a}{x}$,解得x值;然后根据体积V=$\frac{N}{{N}_{A}}Vm$来计算体积;
④根据M=ρVm计算混合气体的平均摩尔质量,根据十字交叉法计算混合气体中NH3和CH4的体积比.然后根据密度之比等于摩尔质量之比来计算.
解答 解:①19.6g硫酸的物质的量n=$\frac{m}{M}$=$\frac{19.6g}{98g/mol}$=0.2mol;而硫酸为7原子分子,故0.2mol硫酸中含有1.4mol原子,个数为1.4NA个;1.7g氨气的物质的量为n=$\frac{1.7g}{17g/mol}$=0.1mol,而氨气中含3个H原子,故0.1mol氨气中含0.3molH原子,而H2S中含2个H原子,故含相同H原子数的H2S的物质的量为n=$\frac{0.3mol}{2}$=0.15mol,质量m=nM=0.15mol×34g/mol=5.1g.
故答案为:0.2;1.4NA;5.1;
②标准状况下,Vm=222.4L/mol,
1.6g某气态氧化物RO2的体积为0.56L,
其物质的量为$\frac{0.56L}{22.4L/mol}$=0.025mol,
其摩尔质量为$\frac{1.6g}{0.025mol}$=64g/mol,故RO2的相对分子质量为64.
则R的相对原子质量=64-16×2=32.
故答案为:0.025mol;64g/mol;32;
③Wg气体A含有a个分子,设bg气体含有的分子数为x个,则有:$\frac{wg}{bg}=\frac{a}{x}$,解得x=$\frac{ab}{w}$;在标况下的体积V=$\frac{N}{{N}_{A}}Vm$=$\frac{\frac{ab}{w}}{{N}_{A}/mol}×22.4L/mol$=$\frac{22.4ab}{w{N}_{A}}$L,故答案为:$\frac{22.4ab}{w{N}_{A}}$L;
④混合气体在标准状况下的密度为0.75g/L,
则混合气体的平均摩尔质量为0.75g/L×22.4L/mol=16.8g/mol.
根据十字交叉法计算混合气体中NH3和CH4的体积比: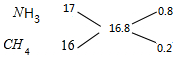
所以混合气体中NH3和CH4的体积比为0.8:0.2=4:1.
即氨气的体积分数=$\frac{4}{5}×100%$=80%;
由于混合气体的平均摩尔质量为16.8g/mol,而氢气的摩尔质量为2g/mol,故混合气体对氢气的相对密度为$\frac{16.8}{2}$=8.4.
故答案为:80%;16.8g/mol;8.4.
点评 本题考查物质的量的有关计算和混合物的计算,难度中等,本题采取十字交叉法计算,简化计算.采取常见解法,容易理解,但计算繁琐,容易出错.

 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案| A. |  制取氨气 | B. |  制取NaHCO3 | C. |  分离NaHCO3 | D. |  干燥NaHCO3 |
| 序号 | 实验操作 | 实验现象 | 实验结论 |
| A | 向某无色溶液中滴加盐酸 | 产生能使澄清石灰水变浑浊气体 | 说明溶液中一定含有CO32- |
| B | 向某无色溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 说明溶液中一定含有SO42- |
| C | 向某溶液中先滴加KSCN溶液,再滴加氯水 | 先无明显现象,后出现血红色溶液 | 说明溶液中一定含有Fe2+ |
| D | 向一定浓度的Na2SiO3溶液中通入适量的CO2 | 出现白色沉淀 | 说明H2CO3的酸性比H2SiO3强 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 金属钠投入到硫酸铜的溶液中不能置换得到铜单质 | |
| B. | 金属钠着火燃烧时,可以用水灭火 | |
| C. | 铝比铁活泼,所以铝比铁更容易被腐蚀 | |
| D. | 正常雨水PH等于7,酸雨的PH小于7 |
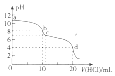 常温下,用0.1mol•L-1的HC1溶液滴定10m L 0.1mol•L-1的Na2CO3溶液,滴定曲线如图所示.下列说法正确的是( )
常温下,用0.1mol•L-1的HC1溶液滴定10m L 0.1mol•L-1的Na2CO3溶液,滴定曲线如图所示.下列说法正确的是( )| A. | 该滴定过程应选择酚酞作指示剂 | |
| B. | a点时,溶液中存在:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| C. | b点时,溶液中存在:c(CO32-)+c(HCO3-)+c( H2CO3)=0.05 mol•L-1 | |
| D. | d点时,溶液中存在电离平衡:H2CO3?2 H++CO32- |
| A. | 硫酸和硝酸是重要的工业原料,工业上可用于制化肥、农药、和炸药 | |
| B. | 石英砂可以用于制取高纯度的硅,硅是将太阳能转化为电能的常用材料 | |
| C. | 因为氨易液化,在汽化时会吸收大量的热量,所以可作制冷剂 | |
| D. | SO2和氯水遇到紫色石蕊试液都先变红后褪色 |
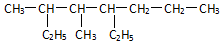 的系统命名为3,4-二甲基-5-乙基辛烷.若该烷烃是由某炔烃与H2发生加成反应而得到的产物,则符合题意的炔烃分子有4种.
的系统命名为3,4-二甲基-5-乙基辛烷.若该烷烃是由某炔烃与H2发生加成反应而得到的产物,则符合题意的炔烃分子有4种. ,现有一种有机物X的键线式如图所示:
,现有一种有机物X的键线式如图所示: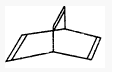
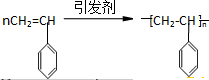 .
. .
.