题目内容
2.使溶液中Al3+完全转化成Al(OH)3,应该选择的最好试剂是( )| A. | HCl | B. | H2SO4 | C. | 氨水 | D. | NaOH |
分析 根据题意,Al3+转化为不溶于水的物质是Al(OH)3,Al(OH)3具有两性,既能和强酸酸反应又能和强碱反应,要使明矾溶液中的Al3+完全沉淀,选取试剂时就不能选强碱,只能是弱碱,由此分析解答.
解答 解:A.盐酸不与氯化铝反应,故A不符合;
B.硫酸不与氯化铝反应,故B不符合;
C.氨水与氯化铝反应生成氢氧化铝沉淀,氨水是弱碱溶液,不能溶解Al(OH)3,可以全部沉淀Al3+,故C符合;
D.氢氧化铝是两性物质,与氢氧化钠反应,用氢氧化钠要控制氢氧化钠的量,故D不符合;
故选C.
点评 本题考查的是铝化合物的性质等,难度不大,重点考查氢氧化铝的实验室制备,注意基础知识的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.下列物质中,不能由两种单质直接化合得到的是( )
| A. | HCl | B. | Na2O2 | C. | Na2O | D. | FeCl2 |
10. 常温下,用0.1mol•L-1的HC1溶液滴定10m L 0.1mol•L-1的Na2CO3溶液,滴定曲线如图所示.下列说法正确的是( )
常温下,用0.1mol•L-1的HC1溶液滴定10m L 0.1mol•L-1的Na2CO3溶液,滴定曲线如图所示.下列说法正确的是( )
 常温下,用0.1mol•L-1的HC1溶液滴定10m L 0.1mol•L-1的Na2CO3溶液,滴定曲线如图所示.下列说法正确的是( )
常温下,用0.1mol•L-1的HC1溶液滴定10m L 0.1mol•L-1的Na2CO3溶液,滴定曲线如图所示.下列说法正确的是( )| A. | 该滴定过程应选择酚酞作指示剂 | |
| B. | a点时,溶液中存在:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| C. | b点时,溶液中存在:c(CO32-)+c(HCO3-)+c( H2CO3)=0.05 mol•L-1 | |
| D. | d点时,溶液中存在电离平衡:H2CO3?2 H++CO32- |
17.下列化学物质在实际生产生活和科技等方面的应用不正确的是( )
| A. | 硫酸和硝酸是重要的工业原料,工业上可用于制化肥、农药、和炸药 | |
| B. | 石英砂可以用于制取高纯度的硅,硅是将太阳能转化为电能的常用材料 | |
| C. | 因为氨易液化,在汽化时会吸收大量的热量,所以可作制冷剂 | |
| D. | SO2和氯水遇到紫色石蕊试液都先变红后褪色 |
11.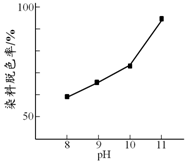 H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂.有研究表明,H2O2溶液的漂白性是HO2-所致.
H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂.有研究表明,H2O2溶液的漂白性是HO2-所致.
(1)H2O2溶液显弱酸性,测得0.15mol•L-1H2O2溶液pH约为6.写出H2O2生成HO2-的电离方程式:H2O2?HO2-+H+.
(2)其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如下:由图可得到的结论是其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好,结合平衡移动原理简述理由:c(OH-)增大,促使H2O2?HO2-+H+正向移动,c(HO2-)增大.
(3)实验发现:若pH>11,则H2O2溶液的漂白效果随pH增大而降低.针对这一现象,继续进行实验,发现溶液中H2O2的分解与pH有关.测定不同初始pH条件下,初始浓度均为0.15mol•L-1的H2O2溶液发生分解反应,结果如表:
查阅资料:HO2-+H2O2═H2O+O2+OH-.
①结合离子方程式解释1小时后pH没有明显变化的原因:碱性条件下:H2O2+OH-═HO2-+H2O,又知HO2-+H2O2═H2O+O2+OH-,OH-可看作是H2O2分解反应的催化剂,故反应前后pH不变.
②从反应速率的角度分析pH过大,H2O2溶液漂白效果会降低的原因:pH过大,H2O2分解过快,使参与漂白的c(HO2-)下降,故漂白效果降低.
 H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂.有研究表明,H2O2溶液的漂白性是HO2-所致.
H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂.有研究表明,H2O2溶液的漂白性是HO2-所致.(1)H2O2溶液显弱酸性,测得0.15mol•L-1H2O2溶液pH约为6.写出H2O2生成HO2-的电离方程式:H2O2?HO2-+H+.
(2)其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如下:由图可得到的结论是其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好,结合平衡移动原理简述理由:c(OH-)增大,促使H2O2?HO2-+H+正向移动,c(HO2-)增大.
(3)实验发现:若pH>11,则H2O2溶液的漂白效果随pH增大而降低.针对这一现象,继续进行实验,发现溶液中H2O2的分解与pH有关.测定不同初始pH条件下,初始浓度均为0.15mol•L-1的H2O2溶液发生分解反应,结果如表:
| 初始pH | pH=10 | pH=12 |
| 1小时后H2O2溶液浓度 | 0.13mol•L-1 | 0.07mol•L-1 |
| 1小时后pH | 没有明显变化 | 没有明显变化 |
①结合离子方程式解释1小时后pH没有明显变化的原因:碱性条件下:H2O2+OH-═HO2-+H2O,又知HO2-+H2O2═H2O+O2+OH-,OH-可看作是H2O2分解反应的催化剂,故反应前后pH不变.
②从反应速率的角度分析pH过大,H2O2溶液漂白效果会降低的原因:pH过大,H2O2分解过快,使参与漂白的c(HO2-)下降,故漂白效果降低.
 .
.