题目内容
9.醋酸是一种常见的弱酸,回答下列问题:(1)醋酸的电离方程式是CH3COOH?CH3COO-+H+;
在0.1mol•L-1醋酸中加入下列物质,醋酸的电离平衡及平衡时物质的浓度的变化:
(2)向醋酸中加入醋酸钠固体,电离平衡向左移动(填向左、向右或不变,下同);
c(H+)减小(填增大、减小或不变,下同),pH增大(填增大、减小或不变,下同)
(3)向醋酸中加入碳酸钙固体,电离平衡向向右移动;c(CH3COOH)减小.
(4)向醋酸中加入大量的水,c(OH-)增大.导电能力减小,电离平衡常数不变.
分析 (1)醋酸为弱酸,存在电离平衡;
(2)向醋酸中加入醋酸钠固体,醋酸根离子浓度增大,平衡逆向移动;
(3)向醋酸中加入碳酸钙固体,氢离子与碳酸钙反应,氢离子浓度减小,平衡正向移动;
(4)稀释促进电离,离子浓度越小,导电性越小,Ka只与温度有关.
解答 解:(1)醋酸为弱酸,其电离方程式是CH3COOH?CH3COO-+H+,故答案为:CH3COOH?CH3COO-+H+;
(2)向醋酸中加入醋酸钠固体,醋酸根离子浓度增大,平衡向左移动,则c(H+)减小,pH增大,
故答案为:向左;减小;增大;
(3)向醋酸中加入碳酸钙固体,氢离子与碳酸钙反应,氢离子浓度减小,平衡向右移动,c(CH3COOH)减小,
故答案为:向右;减小;
(4)稀释促进电离,离子浓度越小,导电性越小,Ka只与温度有关,则向醋酸中加入大量的水,c(H+)减小,c(OH-)增大,导电能力减小,电离平衡常数不变,
故答案为:增大;减小;不变.
点评 本题考查弱电解质的电离平衡,为高频考点,把握电离平衡移动、离子浓度及Ka为解答的关键,侧重分析与应用能力的考查,注意Ka只与温度有关,题目难度不大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
20.下列说法或做法正确的是( )
| A. | 金属钠投入到硫酸铜的溶液中不能置换得到铜单质 | |
| B. | 金属钠着火燃烧时,可以用水灭火 | |
| C. | 铝比铁活泼,所以铝比铁更容易被腐蚀 | |
| D. | 正常雨水PH等于7,酸雨的PH小于7 |
17.下列化学物质在实际生产生活和科技等方面的应用不正确的是( )
| A. | 硫酸和硝酸是重要的工业原料,工业上可用于制化肥、农药、和炸药 | |
| B. | 石英砂可以用于制取高纯度的硅,硅是将太阳能转化为电能的常用材料 | |
| C. | 因为氨易液化,在汽化时会吸收大量的热量,所以可作制冷剂 | |
| D. | SO2和氯水遇到紫色石蕊试液都先变红后褪色 |
4.已知还原性:I->Fe2+>Br-.向含有Cl-、Fe2+、Br-、I-各0.1mol (其余为Na+)的溶液中通入标准状况下的氯气,通入氯气的体积和相关离子的物质的量的关系正确的是( )
| A. | 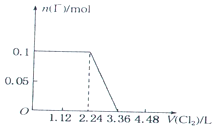 | B. | 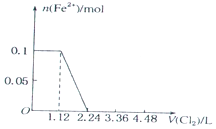 | ||
| C. | 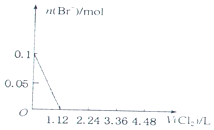 | D. | 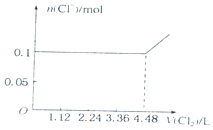 |
18.下列说法正确的是( )
| A. | 乙醇的沸点高于丙烷 | |
| B. | 油脂和蛋白质都是高分子化合物 | |
| C. | CH2=C(CH3)2的名称是2-甲基-2-丙烯 | |
| D. | 对二甲苯的核磁共振氢谱有4个吸收峰 |
19.下列说法不正确的是( )
| A. | 氢能、太阳能、核能均为新能源 | |
| B. | 生物质能的利用主要有直接燃烧、生物化学转换和热化学转换等方式 | |
| C. | 通过煤的气化、液化等物理方法将煤转化为CO、CH4等燃料气体,可以提高煤燃烧的热效率 | |
| D. | 地球上最基本的能源是太阳能,大自然利用太阳能最成功的是植物的光合作用 |
 C、Si是构成无机非金属材料的重要元素.
C、Si是构成无机非金属材料的重要元素.