题目内容
4.一定温度下,在三个体积均为2.0L的恒容密闭容器中发生反应:PCl5(g)?PCl3(g)+Cl2(g),相关信息如表所示:| 编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | 2 |
| Ⅱ | 320 | 0.80 | t1 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
| A. | 平衡常数K:容器Ⅱ>容器Ⅲ | |
| B. | 反应到达平衡时,容器Ⅱ中PCl5的转化率小于25% | |
| C. | 反应到达平衡时,容器I中的平均速率为v(PCl5)=0.05mol•L-1•s-1 | |
| D. | 起始时向容器Ⅲ中充入0.30molPCl5、0.45molPCl3和0.10molCl2,则反应将向逆反应方向进行 |
分析 A.I与Ⅲ起始量相同,温度不同,温度高时,生成物的物质的量大,可知升高温度,平衡正向移动;
B.I中PCl5的转化率为$\frac{0.10}{0.40}$×100%=25%,Ⅱ中起始量大,压强大,增大压强平衡逆向移动;
C.由反应可知转化的n(PCl5)=0.1mol,结合v=$\frac{△c}{△t}$计算;
D.PCl5(g)?PCl3(g)+Cl2(g),
开始 0.2 0 0
转化 0.075 0.075 0.075
平衡 0.125 0.075 0.075
K=$\frac{0.075×0.075}{0.125}$=0.045,
起始时向容器Ⅲ中充入0.30molPCl5、0.45molPCl3和0.10molCl2,Qc=$\frac{0.225×0.05}{0.15}$=0.075>K.
解答 解:A.I与Ⅲ起始量相同,温度不同,温度高时,生成物的物质的量大,可知升高温度,平衡正向移动,正反应为吸热反应,温度高时K大,则平衡常数K:容器Ⅱ<容器Ⅲ,故A错误;
B.I中PCl5的转化率为$\frac{0.10}{0.40}$×100%=25%,Ⅱ中起始量大,压强大,增大压强平衡逆向移动,则容器Ⅱ中PCl5的转化率小于25%,故B正确;
C.由反应可知转化的n(PCl5)=0.1mol,容器I中的平均速率为v(PCl5)=$\frac{\frac{0.10mol}{2L}}{2s}$=0.025mol•L-1•s-1,故C错误;
D.PCl5(g)?PCl3(g)+Cl2(g),
开始 0.2 0 0
转化 0.075 0.075 0.075
平衡 0.125 0.075 0.075
K=$\frac{0.075×0.075}{0.125}$=0.045,
起始时向容器Ⅲ中充入0.30molPCl5、0.45molPCl3和0.10molCl2,Qc=$\frac{0.225×0.05}{0.15}$=0.075>K,平衡逆向移动,故D正确;
故选BD.
点评 本题考查化学平衡的计算,为高频考点,把握表格中数据、温度对K及平衡的影响、K的计算为解答的关键,侧重分析与计算能力的考查,注意选项D为解答的难点,题目难度中等.

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案| A. | 减小NH3的浓度 | B. | 降低反应体系的温度 | ||
| C. | 降低压强 | D. | 缩小容器体积 |
| A. | 探究SO2和Na2O2可能化合生成Na2SO4 | |
| B. | 探究NO和N2O可能化合生成NO2 | |
| C. | 探究铜在灼烧时出现的黑色物质可能是炭黑 | |
| D. | 探究红色酚酞试液通入Cl2褪色,原因是溶液酸碱性改变或被漂白 |
| A. |  | B. |  | C. |  | D. |  |
C(石墨,s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
C(金刚石,s)+O2(g)═CO2(g)△H=-395.4kJ•mol-1
据此推理所得到的下列结论中,正确的是( )
| A. | 金刚石燃烧比石墨燃烧放出的热量少 | |
| B. | 等质量是石墨燃烧放热多 | |
| C. | 石墨的能量比金刚石的能量高 | |
| D. | 由石墨制备金刚石一定是吸热反应 |
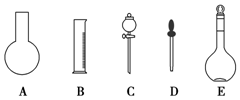 实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题: