题目内容
16.钛酸钡是一种强介电化合物材料,具有高介电常数和低介电损耗,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”,工业制取方法如图,先获得不溶性草酸氧钛钡晶体[BaTiO(C2O4)2•4H2O],煅烧后可获得钛酸钡粉体.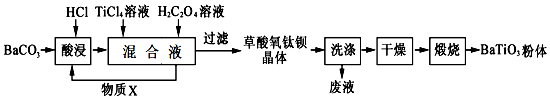
(1)酸浸时发生的反应的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O;
(2)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是抑制TiCl4的水解;
(3)加入H2C2O4溶液时,发生反应的化学方程式为BaCl2+TiCl4+2H2C2O4+5H2O=BaTiO(C2O4)2•4H2O↓+6HCl;可循环使用的物质X是HCl(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:取最后一次洗涤液少许,滴入硝酸酸化的硝酸银,若无沉淀生成,则说明晶体已经洗涤干净;
(4)煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成高温下的气体产物有CO、CO2和H2O(g);
(5)工业上用饱和Na2CO3溶液处理重晶石(主要成分是BaSO4),待达到平衡后,移走上层清液,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐.已知常温下:Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.58×10-9,请问至少需要2.59×10-4 mol•L-1的碳酸钠溶液浸泡才能实现上述转化(忽略CO32-的水解).
分析 由制备流程可知,碳酸钡与盐酸反应生成氯化钡,然后氯化钡与四氯化碳、草酸反应生成BaTiO(C2O4)2•4H2O,过滤、洗涤、干燥、煅烧得到BaTiO3,
(1)碳酸钡与盐酸反应生成氯化钡、水、二氧化碳;
(2)TiCl4可发生水解反应;
(3)加入H2C2O4溶液生成草酸氧钛钡晶体,同时生成HCl可循环使用;可用硝酸银检验沉淀是否洗涤干净;
(4)BaTiO(C2O4)2•4H2O煅烧,发生分解反应,生成高温下的气体产物有CO、CO2、H2O(g);
(5)根据Ksp(BaSO4)计算饱和溶液中硫酸根离子的浓度,再根据平衡常数计算c(CO32-).
解答 解:(1)碳酸钡与盐酸反应生成氯化钡、水、二氧化碳,离子反应为BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
(2)TiCl4可发生水解反应,则通常将TiCl4溶于浓盐酸,目的是抑制TiCl4的水解,故答案为:抑制TiCl4的水解;
(3)入H2C2O4溶液生成草酸氧钛钡晶体,反应为BaCl2+TiCl4+2H2C2O4+5H2O=BaTiO(C2O4)2•4H2O↓+6HCl,同时生成HCl(或盐酸)可循环使用,检验沉淀是否洗涤干净,可取最后一次洗涤液少许,滴入硝酸酸化的硝酸银,若无沉淀生成,则说明晶体已经洗涤干净,
故答案为:BaCl2+TiCl4+2H2C2O4+5H2O=BaTiO(C2O4)2•4H2O↓+6HCl;HCl;取最后一次洗涤液少许,滴入硝酸酸化的硝酸银,若无沉淀生成,则说明晶体已经洗涤干净;
(4)BaTiO(C2O4)2•4H2O煅烧,发生分解反应,由元素守恒可知,生成高温下的气体产物有CO、CO2、H2O(g),故答案为:CO2;H2O(g);
(5)已知Ksp(BaSO4)=1.0×10-10,则饱和硫酸钡溶液中硫酸根离子的浓度c(SO42-)=$\sqrt{Ksp(BaS{O}_{4})}$=1.0×10-5mol/L,则c(CO32-)=$\frac{2.59×1{0}^{-9}}{1.0×1{0}^{-5}}$mol/L=2.59×10-4mol/L;
故答案为:2.59×10-4.
点评 本题考查物质制备实验,为高频考点,把握物质的性质及流程中的反应为解答的关键,侧重分析、实验能力及混合物分离提纯实验设计能力的考查,题目难度中等.

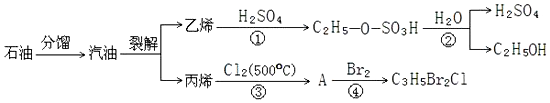
| A. | 石油分馏和裂解均属于化学变化 | |
| B. | 反应①②表明硫酸可用于乙烯水化法制乙醇的催化剂 | |
| C. | 反应①与反应④均属于加成反应 | |
| D. | 反应③的原子利用率为100% |
| A. | 反应①的平衡常数K1=$\frac{c(C{O}_{2})•c(Cu)}{c(CO)•c(CuO)}$ | |
| B. | 反应③的平衡常数K=$\frac{{K}_{1}}{{K}_{2}}$ | |
| C. | 对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值 | |
| D. | 对于反应②,恒温恒容时,若加入CuO,平衡向正向移动,H2的浓度减小 |
| 编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | 2 |
| Ⅱ | 320 | 0.80 | t1 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
| A. | 平衡常数K:容器Ⅱ>容器Ⅲ | |
| B. | 反应到达平衡时,容器Ⅱ中PCl5的转化率小于25% | |
| C. | 反应到达平衡时,容器I中的平均速率为v(PCl5)=0.05mol•L-1•s-1 | |
| D. | 起始时向容器Ⅲ中充入0.30molPCl5、0.45molPCl3和0.10molCl2,则反应将向逆反应方向进行 |
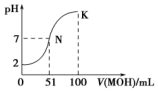
| A. | 1.0mol/L NH4HCO3溶液pH=8.0.由此可知Ka1(H2CO3)>Kb(NH3•H2O)>Ka2(H2CO3) | |
| B. | 向氨水中加入NH4C1固体,溶液中$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$增大 | |
| C. | 向CH3COONa溶液中滴加硫酸至中性时,c(SO42ˉ)<c(CH3COOH) | |
| D. | 图中曲线可以表示向100mL 0.01 mol/LCH3COOH溶液中逐滴加入0.02mol/L NaOH溶液的pH变化情况(溶液体积变化忽略不计) |
| A. | 3molH2+1molN2 | B. | 2molNH3+1molN2 | ||
| C. | 2molN2+3molH2 | D. | 0.1molNH3+0.95molN2+2.85molH2 |
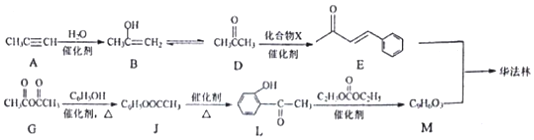
 .
.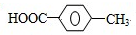 ,R→S的化学方程式为
,R→S的化学方程式为 .
.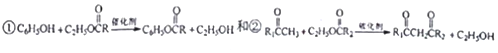
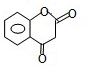 .
.